
已知A、B、C为中学化学中常见单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们有如图所示的转化关系。
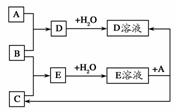
回答下列问题。
(1)A、B、C三种单质的组成元素中的任意两种形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
理由是______________________________________________________。
(2)A、B、C中有一种是金属,则三种单质中可能是金属的是________,理由是____________________________________________________________。
(3)如果E溶液是一种强酸,写出E作为还原剂参加反应的离子方程式:_________________________________________________________________。
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
下列能达到实验目的的是( )
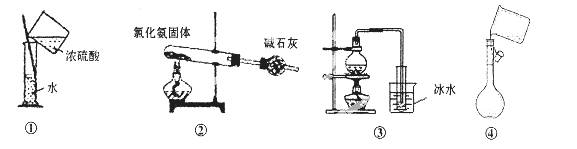
A. 用装置①稀释浓硫酸
B. 用装置②制备氨气
C. 用装置③从海水中制备少量蒸馏水
D. 用装置④向容量瓶中转移溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
为了说明影响化学反应速率快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A﹣D四个实验,你认为结论不正确的是( )
|
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 |
|
| B. | 将表面积、质量都相同的镁条和铝条分别与同浓度的盐酸反应,前者速率大于后者 |
|
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
|
| D. | 相同条件下等质量的块状和粉末状大理石分别与相同浓度的盐酸反应时,粉末状的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
只给出下列甲和乙中对应的量,不能求出物质的量的是 ( )
| A | B | C | D | |
| 甲 | 物质的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
| 乙 | 阿伏加德罗常数 | 标准状况下的气体体积 | 固体的密度 | 溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在酸性溶液中,高锰酸钾发生的反应是MnO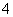 +5e-+8H+===Mn2++4H2O。下列离子能让此反应过程发生的是 ( )
+5e-+8H+===Mn2++4H2O。下列离子能让此反应过程发生的是 ( )
①Fe2+ ②C2O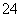 ③SiO
③SiO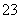 ④IO
④IO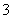
A.①② B.①③
C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
试回答下列问题:
(1)已知24 g A和40 g B恰好完全反应生成0.4 mol C和32 g D,则C的摩尔质量为________。
(2)把1 mol Na和1 mol Mg分别投入到等量且过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma________mb。
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19 g·cm-3 HCl的质量分数:36.5% |
①该浓盐酸中HCl的物质的量浓度为________mol·L-1。
②标准状况下,1.00 L水(密度为1.00 g·cm-3)吸收________L的HCl可制得上述浓盐酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g)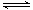 H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=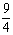 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
下列判断不正确的是
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
在标准状况下,1体积水溶解336体积氯化氢,所得溶液密度为1.1g/cm3,溶液中气体的物质的量浓度和溶质的质量分数分别为( )
A.10.7mol/L 35.4% B.14.8 mol/L 28.8%
C.14.8 mol/L 35.4% D.10.7mol/L 28.8%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com