
为了说明影响化学反应速率快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A﹣D四个实验,你认为结论不正确的是( )
|
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 |
|
| B. | 将表面积、质量都相同的镁条和铝条分别与同浓度的盐酸反应,前者速率大于后者 |
|
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
|
| D. | 相同条件下等质量的块状和粉末状大理石分别与相同浓度的盐酸反应时,粉末状的反应速率快 |
| 化学反应速率的影响因素;探究温度、压强对化学反应速率的影响. . | |
| 专题: | 化学反应速率专题. |
| 分析: | A.铜不能置换出氢气; B.不同的金属,性质不同,为影响化学反应速率的主要因素; C.催化剂能加快反应速率; D.固体的表面积不同,化学反应速率不同. |
| 解答: | 解:A.铜为不活泼金属,与稀硫酸不反应,故A错误; B.镁条和铝条的活泼性不同,与相同浓度盐酸反应,镁反应速率较大,故B正确; C.催化剂能加快反应速率,在氯酸钾分解的试验中,二氧化锰起到催化剂的作用,故C正确; D.固体的表面积不同,化学反应速率不同,粉末状固体的表面积比块状固体表面积大,反应速率大,故D正确. 故选A. |
| 点评: | 本题考查外界条件对化学反应速率的影响,题目难度不大,注意B项,为易错点,物质的性质是影响化学反应速率的主要因素. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.相同条件下,N2和O3混合气体与等体积的N2所含的原子数相同
B.等物质的量的CH4和OH—所含电子数相等
C.常温常压下,28g CO与22.4L O2所含分子数相等
D.16g CH4与18g NH4+所含质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是硫酸试剂瓶标签上的内容
(Ⅰ)该硫酸的物质的量浓度是 mol/L
(II)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL
|
可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管
⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙
请回答下列问题:
(1)上述仪器中,在配置稀硫酸时用不到的有 (填代号)
(2)经计算,需浓硫酸的体积为 。现有①10mL②50mL③100mL三种规格的量筒,你选用的量筒是 (填代号)将上述硫酸进行稀释的实验操作为
。
(3)在配制稀硫酸过程中,其他操作都准确,能引起误差偏高的有 (填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
②容量瓶用1mol/L稀硫酸润洗
③转移前,容量瓶中含有少量蒸馏水
④量取浓硫酸时俯视读刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式正确的是( )
|
| A. | NH3•H2O═NH4﹣+OH﹣ | B. | NaHCO3═Na++H++CO32﹣ |
|
| C. | CH3COONa═CH3COO﹣+Na+ | D. | H2S⇌2H++S2﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应mA(g)+nB(g)⇌pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3mol/L,又测得平均反应速率v(C)=2v(B).达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为
( )
|
| A. | 2A(g)+6B(g)⇌3C(g)+5D(g) | B. | 3A(g)+B(g)⇌2C(g)+2D(g) | C. | 3A(g)+B(g)⇌2C(g)+D(g) | D. | A(g)+3B(g)⇌2C(g)+2D(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)⇌qZ(g)△H>0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
|
| A. | 升高温度: |
|
| B. | 降低温度,混合气体的平均相对分子质量减小 |
|
| C. | 通入稀有气体,压强增大,平衡向正反应方向移动 |
|
| D. | X的正反应速率是Y的逆反应速率的倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式 2CH3OH(g)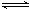 CH3OCH3(g)+H2O(g) .
CH3OCH3(g)+H2O(g) .
(2)该反应的正反应是 吸热 反应(填“放热”或者“吸热”),
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度/(mol•L﹣1) | 0.54 | 0.68 | 0.68 |
①此时系统温度400℃,比较正、逆反应速率的大小:v正 > v逆 (填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中 A 点.比较图中B、D两点所对应的正反应速率B < D(填“>”、“<”或“=”).理由是 D点温度高于B点,温度越高反应速率越大,所以反应速率也大于B .
(4)一定条件下要提高反应物的转化率,可以采用的措施是 ae
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物.

查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C为中学化学中常见单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们有如图所示的转化关系。
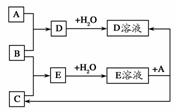
回答下列问题。
(1)A、B、C三种单质的组成元素中的任意两种形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
理由是______________________________________________________。
(2)A、B、C中有一种是金属,则三种单质中可能是金属的是________,理由是____________________________________________________________。
(3)如果E溶液是一种强酸,写出E作为还原剂参加反应的离子方程式:_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下存在反应:C(s)+H2O(g)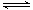 CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1 ℃ | T2 ℃ | T1 ℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1< T2

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com