
已知反应mX(g)+nY(g)⇌qZ(g)△H>0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
|
| A. | 升高温度: |
|
| B. | 降低温度,混合气体的平均相对分子质量减小 |
|
| C. | 通入稀有气体,压强增大,平衡向正反应方向移动 |
|
| D. | X的正反应速率是Y的逆反应速率的倍 |
| 化学平衡的影响因素. . | |
| 专题: | 化学平衡专题. |
| 分析: | A、反应是吸热反应,升温,平衡正向进行, B、反应是放热反应,降温平衡正向进行,反应前后气体体积减小,过程中气体质量不变,相对分子质量增大; C、通入稀有气体总压增大,分压不变,平衡不动; D、速率之比等于化学方程式的系数之比,平衡状态正逆反应速率相同. |
| 解答: | 解:A、反应是吸热反应,升温,平衡正向进行 B、反应是放热反应,降温平衡正向进行,反应前后气体体积减小,过程中气体质量不变,混合气体的相对分子质量增大,故B正确; C、通入稀有气体总压增大,分压不变,平衡不动,故C错误; D、速率之比等于化学方程式的系数之比,v(X)正:v(Y)正=m:n,平衡时,X的正反应速率是Y的逆反应速率的倍,故D错误; 故选B. |
| 点评: | 本题考查了化学平衡影响因素分析判断,化学平衡移动原理和反应特征是解题关键,注意惰气对平衡影响分析方法,题目难度中等. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列各组离子中,在溶液中能大量共存,加入氢氧化钠溶液有沉淀析出,加入稀盐酸有气体放出的是 ( )
A.Na+、Ca2+、SO42-、CO32- B.Na+、Ca2+、HCO3-、NO3--
C.K+、Al3+、SO42-、NO3- D.K+、Na+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列选项合理的是 ( )
A.pH皆等于3 的醋酸稀释100倍后,pH为5
B.10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系
可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
在K2Cr2O7溶液中存在如下平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+.向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是( )
|
| A. | 加入X溶液,上述平衡正向移动 |
|
| B. | Cr2O72﹣的物质的量浓度增大 |
|
| C. | X溶液可能是NaOH溶液 |
|
| D. | 再加入H2SO4,可使黄色溶液变为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了说明影响化学反应速率快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A﹣D四个实验,你认为结论不正确的是( )
|
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 |
|
| B. | 将表面积、质量都相同的镁条和铝条分别与同浓度的盐酸反应,前者速率大于后者 |
|
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
|
| D. | 相同条件下等质量的块状和粉末状大理石分别与相同浓度的盐酸反应时,粉末状的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应 2A+B⇌2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①及时分离出C,平衡 正向 移动;(填正向、逆向、不)
②使密闭容器体积增大,A的转化率 减小 ;(填增大、减小、不变)
③如果升高温度,平衡混合物的颜色 变浅 ;(填加深、变浅、不变)
④加入催化剂D,平衡 不变 移动;(填正向、逆向、不)
(2)若A、C为气体,B为固体;
①加压,则A的体积分数 不变 ;(填增大、减小、不变)
②增加B的量,A的转化率 不变 .(填增大、减小、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
只给出下列甲和乙中对应的量,不能求出物质的量的是 ( )
| A | B | C | D | |
| 甲 | 物质的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
| 乙 | 阿伏加德罗常数 | 标准状况下的气体体积 | 固体的密度 | 溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
试回答下列问题:
(1)已知24 g A和40 g B恰好完全反应生成0.4 mol C和32 g D,则C的摩尔质量为________。
(2)把1 mol Na和1 mol Mg分别投入到等量且过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma________mb。
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19 g·cm-3 HCl的质量分数:36.5% |
①该浓盐酸中HCl的物质的量浓度为________mol·L-1。
②标准状况下,1.00 L水(密度为1.00 g·cm-3)吸收________L的HCl可制得上述浓盐酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.一定温度下,反应MgCl2(l)=Mg(l) + Cl2(g)的 △H>0 △S>0
B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g) 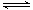 N2O4(g)
N2O4(g)  H<0
H<0
C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D.对于反应2H2O2=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com