
在K2Cr2O7溶液中存在如下平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+.向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是( )
|
| A. | 加入X溶液,上述平衡正向移动 |
|
| B. | Cr2O72﹣的物质的量浓度增大 |
|
| C. | X溶液可能是NaOH溶液 |
|
| D. | 再加入H2SO4,可使黄色溶液变为橙色 |
| 化学平衡的影响因素. . | |
| 专题: | 化学平衡专题. |
| 分析: | 在K2Cr2O7溶液中存在如下平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+,向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,说明平衡正向进行,依据平衡移动原理分析判断. |
| 解答: | 解:A、向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,说明平衡正向进行,故A正确; B、若Cr2O72﹣的物质的量浓度增大,溶液成橙色,故B错误; C、X溶液可能是NaOH溶液,加入和氢离子反应,化学平衡正向进行,溶液成黄色,故C正确; D、加入H2SO4,氢离子浓度增大,平衡逆向进行,可使黄色溶液变为橙色,故D正确; 故选B. |
| 点评: | 本题考查了化学平衡影响因素分析,化学平衡移动原理的应用,掌握反应离子特征和平衡移动方向是关键,题目较简单. |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
已知25℃、101 kPa下,稀的强酸与强碱溶液反应的中和热为57.3 kJ/mol。
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程: 。
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图。
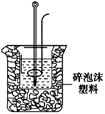 ①实验时所需的玻璃仪器除烧杯、量筒外还需: 。
①实验时所需的玻璃仪器除烧杯、量筒外还需: 。
②该装置中有一处错误是: ,如果用该错误
装置测定,结果会 (填“偏高”“偏低”“无影响”)
③如果该生用50 mL 0.25 mol/L的稀硫酸与50 mL 0.55 mol/L的稀烧
碱溶液,他用试剂的用量的理由是: 。在该实验中需要测
定某种数据,完成一次实验,需要测定该数据的次数为 次。使用正确的装置进
行实验,取上述溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中
和后生成的溶液的比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得
中和热△H=
查看答案和解析>>
科目:高中化学 来源: 题型:
向四支试管中分别加入少量不同的溶液进行如下操作,结论正确的是
| 操作 | 现象 | 结论 | |
| A | 滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| C | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有
;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式正确的是( )
|
| A. | NH3•H2O═NH4﹣+OH﹣ | B. | NaHCO3═Na++H++CO32﹣ |
|
| C. | CH3COONa═CH3COO﹣+Na+ | D. | H2S⇌2H++S2﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中一定能判断某化学平衡发生移动的是( )
|
| A. | 混合物中各组分的浓度发生改变 | B. | 正、逆反应速率发生改变 |
|
| C. | 反应物的转化率发生改变 | D. | 混合体系的压强发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)⇌qZ(g)△H>0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
|
| A. | 升高温度: |
|
| B. | 降低温度,混合气体的平均相对分子质量减小 |
|
| C. | 通入稀有气体,压强增大,平衡向正反应方向移动 |
|
| D. | X的正反应速率是Y的逆反应速率的倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子或分子在溶液中能大量共存,且满足相应要求的是 ( )
| 选项 | 离子或分子 | 要求 |
| A | K+、NO | c(K+)<c(Cl-) |
| B | Fe3+、NO | 逐滴滴加盐酸立即有气体产生 |
| C | Na+、HCO | 逐滴滴加氨水立即有沉淀产生 |
| D | NH | 滴加NaOH浓溶液立刻有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置,A为直流电源,a、b都是惰性电极,通电
一段时间后,b极附近溶液呈红色。下列说法中正确的是
 A.x是阳极,y是阴极
A.x是阳极,y是阴极
B.Pt电极的质量增加
C.a是正极,b是负极
D.CuCl2溶液的pH值基本不变,U形管溶液pH值减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com