
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有
;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
【知识点】元素化合物、氧化还原反应、离子方程式书写、基本实验操作及相关计算
【答案解析】(1)ACD(2分) (2)4FeS + 3O2 + 12H+ = 4Fe3+ + 6H2O + 4S (3分)
(3)Fe(或铁)(2分) (4)蒸发皿、玻璃棒(2分) (5)C (2分)
(6)促进Fe3+的水解(2分) (7)30%(2分)
解析:
(1)过程②中会产生二氧化硫气体,具有漂白性,能使品红溶液褪色;具有还原性,能被酸性KMnO4溶液氧化而使其褪色;也能与溴水发生SO2+Br2+2H2O=H2SO4+2HBr,使溴水褪色。
(2)通过流程图分析,过程①中,FeS和O2、H2SO4反应生成了S单质和硫酸铁,离子方程式是:4FeS + 3O2 + 12H+ = 4Fe3+ + 6H2O + 4S(根据得失电子守恒配平)
(3)绿矾是(FeSO4·7H2O),过程③就是将三价铁还原成二价铁的过程,所以加入铁;
(4)蒸发结晶需要使用酒精灯、三角架、泥三角、蒸发皿、玻璃棒;
(5)聚铁是碱式硫酸铁的聚合物,所以调节PH要用到碱,故选C;
(6)水解吸热,所以加热促进三价铁的水解;
(7)沉淀是硫酸钡,根据关系式:nFe——[(Fe(OH)(SO4)]n——n SO42-——nBaSO4
56n 233n
0.84g 3.495g
铁元素的质量分数:0.84g÷2.8g×100%=30%
【思路点拨】本题主要考查铁的转化及离子水解、二氧化硫的性质、氧化还原反应规律,基本实验操作如过滤、蒸发、蒸馏、萃取等平时要多积累;通过关系式进行计算也是综合题中的考试热点,培养学生综合解决问题的能力。难度中等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列对化学平衡移动的分析中,不正确的是
①已达平衡的反应:C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积,平衡一定向气体体积增大的方向移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是
A.Na2O2 、HClO 、SO2等物质都具有漂白作用
B.液氨、液态氯化氢都是电解质
C.置换反应都是氧化还原反应,复分解反应都是非氧化还原反应
D.明矾能水解生成氢氧化铝胶体,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。
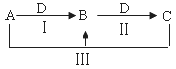
(1)若A为氯碱工业(以电解食盐水生产氯气、氢气和烧碱)的产品,C为厨房中的用品。
① D的化学式是 。
② 反应Ⅲ的离子方程式是 。
③ 氯碱工业制备A的化学方程式是 ,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1 mol KI转移电子0.6 mol,则三种物质间反应的离子方程式是 。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是 。
②鉴别B、C常用的一种试剂是 ; B可作净水剂,其原理
是: (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列选项合理的是 ( )
A.pH皆等于3 的醋酸稀释100倍后,pH为5
B.10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系
可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:H2S(g)+aO2(g)═X+cH2O(l)△H,若△H表示H2S燃烧热,则X为( )
A.S(s) B.SO2(g) C.SO3(g) D.SO3(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
在K2Cr2O7溶液中存在如下平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+.向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是( )
|
| A. | 加入X溶液,上述平衡正向移动 |
|
| B. | Cr2O72﹣的物质的量浓度增大 |
|
| C. | X溶液可能是NaOH溶液 |
|
| D. | 再加入H2SO4,可使黄色溶液变为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应 2A+B⇌2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①及时分离出C,平衡 正向 移动;(填正向、逆向、不)
②使密闭容器体积增大,A的转化率 减小 ;(填增大、减小、不变)
③如果升高温度,平衡混合物的颜色 变浅 ;(填加深、变浅、不变)
④加入催化剂D,平衡 不变 移动;(填正向、逆向、不)
(2)若A、C为气体,B为固体;
①加压,则A的体积分数 不变 ;(填增大、减小、不变)
②增加B的量,A的转化率 不变 .(填增大、减小、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,
还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性;b.稀释ClO2以防止爆炸;c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com