
下列选项合理的是 ( )
A.pH皆等于3 的醋酸稀释100倍后,pH为5
B.10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系
可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
【知识点】电离平衡、水解平衡、离子浓度大小比较、PH的计算
【答案解析】D 解析:A、醋酸是弱酸,稀释促进弱酸的电离,pH等于3 的醋酸稀释100倍后,pH小于5,故A错误;
B、10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH)2溶液充分混合,溶液呈碱性,可以计算氢氧根的浓度,常温下PH值一定大于7,故B错误;
C、二元弱酸强碱盐NaHA溶液中,存在物料守恒:c(Na+)=c(A2-)+c(HA-)+c(H2A)故C错误;
D、室温下,在一定量稀氨水中逐滴滴入稀盐酸,所得溶液中氨水可能过量,离子浓度大小关系可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+),故D正确;
故答案选D
【思路点拨】本题考查PH的计算、离子浓度大小比较反应等知识,主要是弱电解质的电离,注意守恒思想在溶液中的重要应用。


科目:高中化学 来源: 题型:
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:
A(g) + 2B(g) xC(g) ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
xC(g) ΔH=-192kJ·mol-1,向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
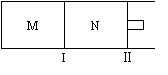
A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C.若x<3,C的平衡浓度关系为:c(M)>c(N)
D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
右图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
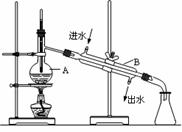
(1)图中明显的两处错误是
①温度计的水银球未置于支管口处
②_________________________________________
(2)B仪器的名称是______________。
(3)实验时A中除加入自来水外,加入沸石的作用是 。若加热后发现未加沸石,应采取的正确方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
向四支试管中分别加入少量不同的溶液进行如下操作,结论正确的是
| 操作 | 现象 | 结论 | |
| A | 滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
| C | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| D | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是硫酸试剂瓶标签上的内容
(Ⅰ)该硫酸的物质的量浓度是 mol/L
(II)某化学兴趣小组进行硫酸性质的实验探究时,需要240mL
|
可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管
⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙
请回答下列问题:
(1)上述仪器中,在配置稀硫酸时用不到的有 (填代号)
(2)经计算,需浓硫酸的体积为 。现有①10mL②50mL③100mL三种规格的量筒,你选用的量筒是 (填代号)将上述硫酸进行稀释的实验操作为
。
(3)在配制稀硫酸过程中,其他操作都准确,能引起误差偏高的有 (填代号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
②容量瓶用1mol/L稀硫酸润洗
③转移前,容量瓶中含有少量蒸馏水
④量取浓硫酸时俯视读刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:

(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有
;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式正确的是( )
|
| A. | NH3•H2O═NH4﹣+OH﹣ | B. | NaHCO3═Na++H++CO32﹣ |
|
| C. | CH3COONa═CH3COO﹣+Na+ | D. | H2S⇌2H++S2﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)⇌qZ(g)△H>0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
|
| A. | 升高温度: |
|
| B. | 降低温度,混合气体的平均相对分子质量减小 |
|
| C. | 通入稀有气体,压强增大,平衡向正反应方向移动 |
|
| D. | X的正反应速率是Y的逆反应速率的倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
A.元素X 的简单气态氢化物的热稳定性比W 的强
B.元素W 的最高价氧化物对应水化物的酸性比Z 的弱
C.化合物YX、ZX2、WX3 中化学键的类型相同
D.原子半径的大小顺序: rY >rZ >rW >rX
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com