
下列各组离子或分子在溶液中能大量共存,且满足相应要求的是 ( )
| 选项 | 离子或分子 | 要求 |
| A | K+、NO | c(K+)<c(Cl-) |
| B | Fe3+、NO | 逐滴滴加盐酸立即有气体产生 |
| C | Na+、HCO | 逐滴滴加氨水立即有沉淀产生 |
| D | NH | 滴加NaOH浓溶液立刻有气体产生 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列说法中不正确的是
A.Na2O2 、HClO 、SO2等物质都具有漂白作用
B.液氨、液态氯化氢都是电解质
C.置换反应都是氧化还原反应,复分解反应都是非氧化还原反应
D.明矾能水解生成氢氧化铝胶体,可用作净水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
在K2Cr2O7溶液中存在如下平衡:Cr2O72﹣+H2O⇌2CrO42﹣+2H+.向橙色的K2Cr2O7溶液中加入X溶液,可使溶液变黄,下列说法一定不正确的是( )
|
| A. | 加入X溶液,上述平衡正向移动 |
|
| B. | Cr2O72﹣的物质的量浓度增大 |
|
| C. | X溶液可能是NaOH溶液 |
|
| D. | 再加入H2SO4,可使黄色溶液变为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应 2A+B⇌2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①及时分离出C,平衡 正向 移动;(填正向、逆向、不)
②使密闭容器体积增大,A的转化率 减小 ;(填增大、减小、不变)
③如果升高温度,平衡混合物的颜色 变浅 ;(填加深、变浅、不变)
④加入催化剂D,平衡 不变 移动;(填正向、逆向、不)
(2)若A、C为气体,B为固体;
①加压,则A的体积分数 不变 ;(填增大、减小、不变)
②增加B的量,A的转化率 不变 .(填增大、减小、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
只给出下列甲和乙中对应的量,不能求出物质的量的是 ( )
| A | B | C | D | |
| 甲 | 物质的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
| 乙 | 阿伏加德罗常数 | 标准状况下的气体体积 | 固体的密度 | 溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁氧磁体法处理含Cr2O 的废水的原理如下:向含Cr2O
的废水的原理如下:向含Cr2O 的酸性废水中加入FeSO4·7H2O,将Cr2O
的酸性废水中加入FeSO4·7H2O,将Cr2O 还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成相当于FeⅡ[Fe
还原为Cr3+,调节溶液的pH,使铁、铬元素转化为组成相当于FeⅡ[Fe ·Cr
·Cr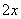 ]O4(铁氧磁体,罗马数字表示元素的价态)的沉淀。处理含1 mol Cr2O
]O4(铁氧磁体,罗马数字表示元素的价态)的沉淀。处理含1 mol Cr2O 的废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是 ( )
的废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是 ( )
A.x=0.5,a=8 B.x=0.5,a=10
C.x=1.5,a=8 D.x=1.5,a=10
查看答案和解析>>
科目:高中化学 来源: 题型:
试回答下列问题:
(1)已知24 g A和40 g B恰好完全反应生成0.4 mol C和32 g D,则C的摩尔质量为________。
(2)把1 mol Na和1 mol Mg分别投入到等量且过量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma________mb。
(3)如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19 g·cm-3 HCl的质量分数:36.5% |
①该浓盐酸中HCl的物质的量浓度为________mol·L-1。
②标准状况下,1.00 L水(密度为1.00 g·cm-3)吸收________L的HCl可制得上述浓盐酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,
还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性;b.稀释ClO2以防止爆炸;c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液氯离子的物质的量浓度与50 mL 1 mol/LAlCl3溶液中氯离子的物质的量浓度相等的是( )
A.50 mL3 mol/L氯酸钠溶液
B.75 mL 1mol/L氯化钙溶液
C.150 mL 3 mol/L氯化钾溶液
D.50 mL 3 mol/L氯化镁溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com