
下列说法正确的是( )
A.相同条件下,N2和O3混合气体与等体积的N2所含的原子数相同
B.等物质的量的CH4和OH—所含电子数相等
C.常温常压下,28g CO与22.4L O2所含分子数相等
D.16g CH4与18g NH4+所含质子数相等
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
设NA表示阿伏伽德罗常数的值,下列说法中正确的 ( )
A.常温下,42 g C2H4和C4H8的混合物中含有的碳原子数为3 NA
B.58.5 g氯化钠固体中含有NA个氯化钠分子;
C.标况下,11.2 L己烷所含的分子数为0.5 NA;
D.1 mol FeCl3完全水解转化为氢氧化铁胶体后生成NA个胶粒;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A. 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行
B. NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) △H=+185.57 kJ·mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)  2SO3(g) ΔH<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
2SO3(g) ΔH<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是
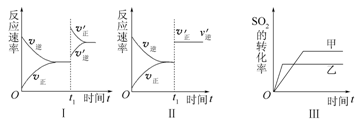
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
⑴处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
⑵利用反应6NO2+ 8NH3 7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
⑶降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0。该反应的
N2(g)+2CO2(g) △H<0。该反应的
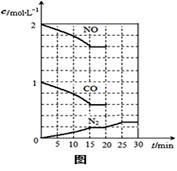 化学平衡常数表达式为K= ,该反应
化学平衡常数表达式为K= ,该反应
ΔS 0(填“>”或“ <”),若在一定温度下,将
2molNO、1molCO充入1L固定容积的容器中,反应过
程中各物质的浓度变化如右图所示。若保持温度不变,
20min时再向容器中充入CO、N2各0.6mol,平衡
将 移动(填“向左”、“向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如图所示
的变化,则改变的条件可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
⑷利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中,在溶液中能大量共存,加入氢氧化钠溶液有沉淀析出,加入稀盐酸有气体放出的是 ( )
A.Na+、Ca2+、SO42-、CO32- B.Na+、Ca2+、HCO3-、NO3--
C.K+、Al3+、SO42-、NO3- D.K+、Na+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
在5NH4NO3═ 2HNO3+4N2↑+9H2O中,发生氧化反应的氮原子和发生还原反应的氮原子的质量比是
A.1:1 B.3:5 C.5:3 D.2:8
查看答案和解析>>
科目:高中化学 来源: 题型:
下列能达到实验目的的是( )
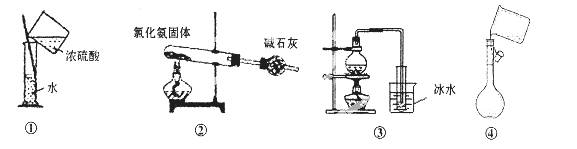
A. 用装置①稀释浓硫酸
B. 用装置②制备氨气
C. 用装置③从海水中制备少量蒸馏水
D. 用装置④向容量瓶中转移溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
为了说明影响化学反应速率快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A﹣D四个实验,你认为结论不正确的是( )
|
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 |
|
| B. | 将表面积、质量都相同的镁条和铝条分别与同浓度的盐酸反应,前者速率大于后者 |
|
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
|
| D. | 相同条件下等质量的块状和粉末状大理石分别与相同浓度的盐酸反应时,粉末状的反应速率快 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com