
在标准状况下,1体积水溶解336体积氯化氢,所得溶液密度为1.1g/cm3,溶液中气体的物质的量浓度和溶质的质量分数分别为( )
A.10.7mol/L 35.4% B.14.8 mol/L 28.8%
C.14.8 mol/L 35.4% D.10.7mol/L 28.8%
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
已知A、B、C为中学化学中常见单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们有如图所示的转化关系。
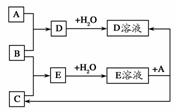
回答下列问题。
(1)A、B、C三种单质的组成元素中的任意两种形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
理由是______________________________________________________。
(2)A、B、C中有一种是金属,则三种单质中可能是金属的是________,理由是____________________________________________________________。
(3)如果E溶液是一种强酸,写出E作为还原剂参加反应的离子方程式:_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下存在反应:C(s)+H2O(g)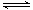 CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1 ℃ | T2 ℃ | T1 ℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1< T2

查看答案和解析>>
科目:高中化学 来源: 题型:
一系列物质:NaCl、Cl2、NaClO、Cl2O5、HClO4是按某一规律排列的,下列组合中也完全照此规律排列的是( )
A、Na2CO3 C CO2 CO NaHCO3
B、Na2S S SO2 Na2SO3 Na2SO4
C、NH4Cl N2 NaNO2 NO2 HNO3
D、P2O5 H3PO4 Na3PO4 Na2HPO4 NaH2PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重124 g,则某气体的相对分子质量为( )
A.48 B. 28 C.32 D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是 ( )
① C与O2 ② Na与O2 ③ Fe与Cl2 ④ AlCl3溶液与NaOH溶液
⑤ CO2与NaOH溶液 ⑥ Cu与硝酸
A.除③外 B.除③⑤外 C.除③④外 D.除⑥外
查看答案和解析>>
科目:高中化学 来源: 题型:
对于下列化学事实,表述错误的是( )
A.浓硝酸需要在棕色瓶中保存,以防止见光分解
B.向Fe(OH)3胶体中逐滴滴入过量的稀硫酸,会出现“先沉淀后溶解”的现象
C.向石蕊试液中滴加氨水,溶液变红
D.除去Na2CO3固体中少量的NaHCO3,常用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,关闭K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
⑴过程Ⅰ的目的是 。
⑵棉花中浸润的溶液为 。
⑶A中发生反应的化学方程式 。
⑷若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为 。
⑸甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
| 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在Fe(NO3)2溶液中存在下列平衡:Fe2++2H2O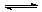 Fe(OH)2+2H+,现向上述溶液中加入稀硫酸,产生的现象是
Fe(OH)2+2H+,现向上述溶液中加入稀硫酸,产生的现象是
A.溶液的颜色变得更绿 B.溶液中出现白色沉淀
C.溶液颜色由绿变黄 D.上述现象均不可能出现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com