
某温度下,H2(g)+CO2(g)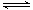 H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=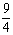 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
下列判断不正确的是
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
下列电离方程式正确的是( )
|
| A. | NH3•H2O═NH4﹣+OH﹣ | B. | NaHCO3═Na++H++CO32﹣ |
|
| C. | CH3COONa═CH3COO﹣+Na+ | D. | H2S⇌2H++S2﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C为中学化学中常见单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们有如图所示的转化关系。
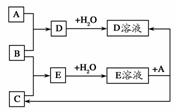
回答下列问题。
(1)A、B、C三种单质的组成元素中的任意两种形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
理由是______________________________________________________。
(2)A、B、C中有一种是金属,则三种单质中可能是金属的是________,理由是____________________________________________________________。
(3)如果E溶液是一种强酸,写出E作为还原剂参加反应的离子方程式:_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
A.元素X 的简单气态氢化物的热稳定性比W 的强
B.元素W 的最高价氧化物对应水化物的酸性比Z 的弱
C.化合物YX、ZX2、WX3 中化学键的类型相同
D.原子半径的大小顺序: rY >rZ >rW >rX
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
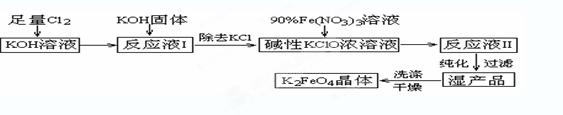
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学
式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示装置,A为直流电源,a、b都是惰性电极,通电
一段时间后,b极附近溶液呈红色。下列说法中正确的是
 A.x是阳极,y是阴极
A.x是阳极,y是阴极
B.Pt电极的质量增加
C.a是正极,b是负极
D.CuCl2溶液的pH值基本不变,U形管溶液pH值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下存在反应:C(s)+H2O(g)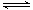 CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1 ℃ | T2 ℃ | T1 ℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1< T2

查看答案和解析>>
科目:高中化学 来源: 题型:
一系列物质:NaCl、Cl2、NaClO、Cl2O5、HClO4是按某一规律排列的,下列组合中也完全照此规律排列的是( )
A、Na2CO3 C CO2 CO NaHCO3
B、Na2S S SO2 Na2SO3 Na2SO4
C、NH4Cl N2 NaNO2 NO2 HNO3
D、P2O5 H3PO4 Na3PO4 Na2HPO4 NaH2PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。

实验过程:
I. 打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ. 打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ. 当B中溶液变黄时,停止加热,关闭K2。
Ⅳ. 打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ. 打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ. 更新试管D,重复过程Ⅳ,检验B溶液中的离子。
⑴过程Ⅰ的目的是 。
⑵棉花中浸润的溶液为 。
⑶A中发生反应的化学方程式 。
⑷若将制取的SO2通入酸性高锰酸钾溶液可使溶液褪色,其离子方程式为 。
⑸甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”)。
| 过程Ⅳ B溶液中含有的离子 | 过程Ⅵ B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com