
下列离子方程式正确的是
A.石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-===CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42—+Ba2++2OH-===BaSO4↓+2H2O
C.氧化铜与稀硫酸反应:2H++O2-===H2O
D.碳酸氢钠溶液中加入盐酸:CO32—+2H+===CO2↑+H2O
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是 ( ) ( )。
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B. 已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b
D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中加入A、B、C三种气体,保持温度一定,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol·L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol·L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol·L-1) | 1 | 2.5 | 3 | 3 |
A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.该温度下此可逆反应平衡常数K=4
D.该反应的化学方程式为2A(g)+B(g) C(g)
C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
⑴处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
⑵利用反应6NO2+ 8NH3 7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
⑶降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0。该反应的
N2(g)+2CO2(g) △H<0。该反应的
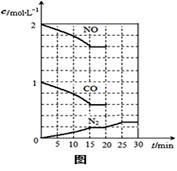 化学平衡常数表达式为K= ,该反应
化学平衡常数表达式为K= ,该反应
ΔS 0(填“>”或“ <”),若在一定温度下,将
2molNO、1molCO充入1L固定容积的容器中,反应过
程中各物质的浓度变化如右图所示。若保持温度不变,
20min时再向容器中充入CO、N2各0.6mol,平衡
将 移动(填“向左”、“向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如图所示
的变化,则改变的条件可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
⑷利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质按纯净物、混合物、电解质、非电解质的顺序组合正确的是( )
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 铜 |
| B | 胆矾 | 石灰水 | 硫酸钡 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠溶液 | 三氧化硫 |
| D | 冰醋酸 | 氢氧化铁胶体 | 苛性钾溶液 | 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在5NH4NO3═ 2HNO3+4N2↑+9H2O中,发生氧化反应的氮原子和发生还原反应的氮原子的质量比是
A.1:1 B.3:5 C.5:3 D.2:8
查看答案和解析>>
科目:高中化学 来源: 题型:
在反应Cu + 4HNO3(浓)=== Cu(NO3)2 + 2NO2↑ + 2H2O中:
(1)上述反应的离子方程式为 。
(2)该反应中氧化剂为_________________,氧化产物为_________________(填化学式)
(3)当该反应有32gCu被消耗,被还原的HNO3的物质的量是_____________,转移的电子的物质的量是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:下列有关说法不正确的是 ( )
①SO2+2Fe3++2H2O===SO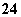 +2Fe2++4H+
+2Fe2++4H+
②Cr2O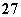 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
A.氧化性Cr2O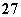 >Fe3+>SO2
>Fe3+>SO2
B.Cr2O 能将Na2SO3氧化成Na2SO4
能将Na2SO3氧化成Na2SO4
C.若33.6LSO2(标准状况)参加反应,则最终消耗K2Cr2O7 0.5mol
D.每反应1molK2Cr2O7 ,转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,若 N2、H2、NH3起始浓度分别为c1、c2、c3(均不为0),当达平衡时N2、H2、NH3的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
|
| A. | c1:c2=1:3 |
|
| B. | N2、H2的转化率不相等 |
|
| C. | 平衡时,H2和NH3的生成速率之比为3:2 |
|
| D. | c1的取值范围为0<c1<0.14 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com