
 �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
A��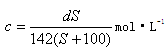 | B��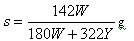 |
| C��100X=YS | D��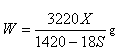 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
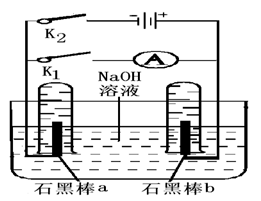
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
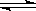 Ag+ + Cl�����ֽ��������Ȼ����ֱ��������ѡ�����Һ�У���ֽ������ͬ�¶��£�������Ũ����С���ǣ� ��
Ag+ + Cl�����ֽ��������Ȼ����ֱ��������ѡ�����Һ�У���ֽ������ͬ�¶��£�������Ũ����С���ǣ� ��| A��100mL����ˮ�� | B��50mL0.1mol?L-1���Ȼ�þ��Һ |
| C��150mL0.1mol?L-1���Ȼ�����Һ | D��50mL0.1mol?L-1���Ȼ�����Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Ӧ��Br2 +2Fe2+=2 Br -+2Fe3+,��10 mL0 .1mol/L��Fe Br2��Һ��ͨ��0 .003mol Cl2���÷�Ӧ�����ӷ���ʽΪ
Ӧ��Br2 +2Fe2+=2 Br -+2Fe3+,��10 mL0 .1mol/L��Fe Br2��Һ��ͨ��0 .003mol Cl2���÷�Ӧ�����ӷ���ʽΪ  ��������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ�����
��������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ����� ����2L�ܱ������м���������Cu2O��ͨ��0 .1molˮ������������Ӧ��
����2L�ܱ������м���������Cu2O��ͨ��0 .1molˮ������������Ӧ��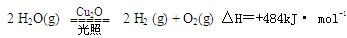 2 H2O(g)
2 H2O(g) | ʱ��/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
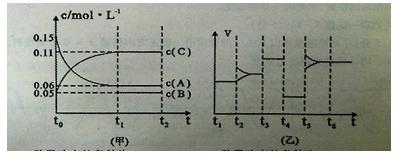
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��9.0 | B��9.5 | C��8.5 | D��10.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
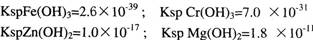
| A��Fe3+ | B��Cr3+ | C��Zn2+ | D��Mg2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ˮ�����ӻ�KW���¶ȡ�����ᣨ�Ũ�ȵĸı���ı� |
| B�����ܵ�������Ƚ�ʱ��KspС���ܽ��һ��С |
| C�����Ѵ�ƽ��ķ�Ӧ�����ı�Ũ�ȣ���ƽ���ƶ�����ƽ�ⳣ����K��һ���ı� |
| D��Kspֻ�����ܵ���ʵ����ʺ��¶��йأ�������Һ�е�����Ũ���� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com