
(10分)现用物质的量浓度为amol·L-1的标准NaOH溶液去滴定VmL盐酸的物质的量浓度,请填写下列空白:
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是________________________。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (选填“甲”或“乙”)中。
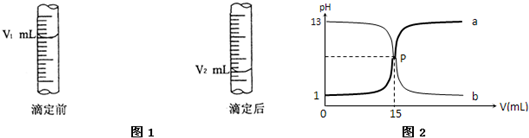
(3)右图是碱式滴定管中液面在滴定前后的读数, c(HCl)=_______________mol·L-1。
(4)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定 管尖嘴部分气泡消失,则滴定的HCl物质的量浓度会偏____________(填“大”或“小”)。
(5)取20.00mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时, NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标志是______________________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)。
科目:高中化学 来源: 题型:
 实验题
实验题| (V2-V1)a |
| V |
| (V2-V1)a |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现用物质的量浓度为a mol?L-1的标准NaOH溶液去滴定V mL硫酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol?L-1的标准NaOH溶液去滴定V mL硫酸的物质的量浓度,请填写下列空白:| a ×(V2-V1) |
| 2V |
| a ×(V2-V1) |
| 2V |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列有关仪器的使用,能实现的是
(1)下列有关仪器的使用,能实现的是| (V2-V1)a |
| V |
| (V2-V1)a |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a(V2-V1) |
| V |
| a(V2-V1) |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a(V2-V1) |
| V |
| a(V2-V1) |
| V |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com