
【题目】有媒体报道一种新型污水处理装置问世,该装置可利用一种微生物将有机废水的化学能直接转化为电能,该装置的构造如图所示。下列说法中正确的是( )
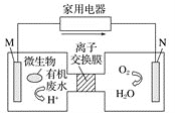
A. 装置外层电路中箭头的方向代表电流的方向
B. 该装置为原电池装置,其中N为负极
C. 该装置为电解池装置,其中M为阳极
D. 若有机废水中含有葡萄糖,则M电极发生的电极反应式为C6H12O6+6H2O-24e-![]() 6CO2+24H+
6CO2+24H+
【答案】D
【解析】
根据题给信息知,该装置是将化学能转化为电能的原电池,由N极上O2得电子被还原成水知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,外电路中电子从负极流向正极,据此分析解答。
根据题给信息知,该装置是将化学能转化为电能的原电池,由N极上O2得电子被还原成水知,M是负极,N是正极,电解质溶液为酸性溶液,负极上失电子发生氧化反应,正极上得电子发生还原反应,外电路中电子从负极流向正极,
A.M是负极,N是正极,外电路中电子从负极流向正极,则装置外电路中箭头的方向代表电子的方向,故A错误;
B.该装置属于原电池,N电极为正极,故B错误;
C.该装置属于原电池,M电极为负极,故C错误;
D.若有机废水中含有葡萄糖,葡萄糖在负极M上失电子发生氧化反应,电极反应式为C6H12O6+6H2O-24e-═6CO2↑+24H+,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】Ⅰ、A、B是两种常见的无机物,它们分别能与下图中周围4种物质在一定条件下反应:
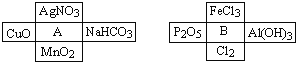
请回答下列问题:
(1)A溶液与B溶液反应的离子方程式 ______ .
(2)若A与其周围某物质在一定条件下反应,产物之一是B周围的一种,则此反应的离子方程式为 ______
(3)在A、B周围的8种物质中,有些既能与A反应又能与B反应.则这些物质可能是: ______ .
Ⅱ、在Na+浓度为0.6mol/L的某澄清溶液中,还可能含有表中的若干种离子:
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SO42-、SiO32- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出0.56L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 在Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
试回答下列问题:
(1)实验I中生成沉淀的离子方程式为______。
(2)实验Ⅱ中判断沉淀是否洗涤干净的操作为:______。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,判断K+______ 一定存在(填“是”或“否”),若存在,其最小浓度为______。(若不存在,此空不需填写)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将12.8g铜片加入到100ml一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400ml、2mol/L NaOH溶液,能使溶液中的Cu2+恰好完全沉淀。下列说法不正确的是
A. 反应后溶液中剩余NO3-的物质的量为0.4mol
B. 原硝酸溶液的物质的量浓度为10mol/L
C. 铜片与硝酸反应过程中转移电子0.4mol
D. 混合气体中NO和NO2的体积之比为1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中以Zn、CrCl3溶液、CH3COONa溶液和盐酸为主要原料制备醋酸亚铬晶体,其装置如下图所示。仪器2中已预先加入锌粒,仪器3中已加人CH3COONa溶液。

资料卡:
①醋酸亚铬晶体[[Cr(CH3COO)2]22H2O;深红色晶体,不溶于冷水,是常用的氧气吸收剂。
②Cr2+不稳定,极易被氧气氧化,不与锌反应。
③部分相关的化学反应:
2CrCl3+Zn═2CrCl2+ZnCl2
2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]22H2O
④Ksp[Cr(OH)3]=6.3×10-31,![]() ≈4,lg2≈0.3
≈4,lg2≈0.3
回答下列问题:
(1)仪器1的名称是_______________。
(2)实验时先往仪器2中加盐酸,一段时间后再加CrCl3溶液,目的是_________。
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门_______,打开阀门_______。
(4)本实验中锌粒要过量,其原因除了使产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是_______________。
(5)铬的离子会污染水资源。常温下要除去上述实验中多余的Cr2+,①先向废液中通入足量的______,将Cr2+转变为Cr3+,反应的离子方程式为_______;②再加入碱液,调节pH至少为_____才能使Cr3+沉淀完全[c(Cr3+)<10-5mol/L]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是燃料(如氢气、甲烷、一氧化碳等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液。下面关于甲烷燃料电池的说法正确的是( )
A. 负极反应式:O2+2H2O+4e-![]() 4OH-
4OH-
B. 负极反应式:CH4+8OH--8e-![]() CO2+6H2O
CO2+6H2O
C. 随着放电的进行,溶液中氢氧根离子的浓度不变
D. 放电时溶液中的阴离子向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废钡渣(主要成分为BaS2O3,含少量SiO2)为原料生产高纯氟化钡的流程如下:
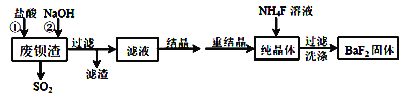
已知:Ksp(BaS2O3)=6.96×10-11,Ksp(BaF2)=1.0×10-6
(1)加入盐酸时除产生SO2外,还有淡黄色固体生成。该反应的离子方程式为___________________________________________________________。
(2)滤液的主要成分有____________。(填化学式)
(3)工业上可用氨水吸收SO2,并通入空气使其转化为铵态氮肥。该转化中氧化剂与还原剂的物质的量之比为_____________。
(4)加入NaOH溶液的目的是中和过量的盐酸,但不宜过量,其原因是____________(用离子反应方程式表示)。
(5)生成BaF2的反应的化学方程式为_________________________。
①若该反应温度过高,容易造成c(F-)降低的原因是_______________________。
②研究表明,适当增加NH4F的比例有利于提高BaF2的产率和纯度。将浓度为0.1 molL-1的BaCl2溶液和0.22molL-1NH4F溶液等体积混合,所得溶液中c(Ba2+)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法测得其中含C 72.0%、H 6.67%,其余为氧;质谱法分析得知A的相对分子质量为150。现代仪器分析有机化合物的分子结构有以下两种方法。
方法一:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1∶2∶2∶2∶3。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如图:
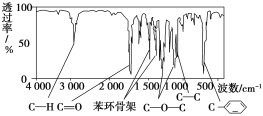
已知:A分子中只含一个苯环,且苯环上只有一个取代基。试回答下列问题。
(1)A的分子式为________。
(2)A的结构简式为_______________________________________________(写一种即可)。
(3)A的芳香化合物类同分异构体有多种,其中分子中不含甲基的芳香酸为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 12C和14C互为同素异形体
B. 金刚石和C60互为同位素
C. CH3-CH2-CH2-CH3和![]() 互为同分异构体
互为同分异构体
D. C2H2和C6H6互为同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com