
ЁОЬтФПЁПвбжЊЗДгІmXЃЈgЃЉ+nYЃЈgЃЉqZЃЈgЃЉЃЌЁїHЃМ0ЃЌm+nЃОqЃЌдкКуШнУмБеШнЦїжаЗДгІДяЕНЦНКтЪБЃЌЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.ШчЙћМЬајЭЈШывЛЖЈСПФГЦјЬхЪЙЬхЯЕбЙЧПдіДѓЃЌЦНКтНЋе§ЯђвЦЖЏ
B.ДЫЪБЃЌXЕФе§ЗДгІЫйТЪЪЧYЕФФцЗДгІЫйТЪЕФ ![]() БЖ
БЖ
C.ШчЙћНЕЕЭЮТЖШЃЌЧвБЃГжЮяжЪзДЬЌВЛЗЂЩњИФБфЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПБфаЁ
D.ШчЙћдіМгXЕФЮяжЪЕФСПЃЌЦНКте§ЯђвЦЖЏЃЌXЕФзЊЛЏТЪдіДѓ
ЁОД№АИЁПB
ЁОНтЮіЁПНтЃКAЁЂКуШнЬѕМўЯТЃЌЭЈШыЯЁгаЦјЬхЪЙбЙЧПдіДѓЃЌЗДгІЛьКЯЮяЕФХЈЖШВЛБфЃЌе§ЁЂФцЗДгІЫйТЪВЛБфЃЌЦНКтВЛвЦЖЏЃЌЙЪAДэЮѓЃЛBЁЂПЩФцЗДгІДяЦНКтЪБВЛЭЌЮяжЪБэЪОЕФе§ЁЂФцЗДгІЫйТЪжЎБШЕШгкЛЏбЇМЦСПЪ§жЎБШЃЌXЕФе§ЗДгІЫйТЪЪЧYЕФФцЗДгІЫйТЪЕФ ![]() БЖЃЌЫЕУїЗДгІЕНДяЦНКтЃЌЙЪBе§ШЗЃЛ
БЖЃЌЫЕУїЗДгІЕНДяЦНКтЃЌЙЪBе§ШЗЃЛ
CЁЂНЕЕЭЮТЖШЦНКтЯђе§ЗДгІвЦЖЏЃЌгЩгкm+nЃОqЃЌЗДгІЛьКЯЦјЬхзмЕФЮяжЪЕФСПМѕаЁЃЌЛьКЯЦјЬхзмжЪСПВЛБфЃЌНсКЯM= ![]() ПЩжЊЛьКЯЦјЬхЕФЦНОљФІЖћжЪСПдіДѓЃЌЙЪНЕЕЭЮТЖШЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПдіДѓЃЌЙЪCДэЮѓЃЛ
ПЩжЊЛьКЯЦјЬхЕФЦНОљФІЖћжЪСПдіДѓЃЌЙЪНЕЕЭЮТЖШЃЌЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПдіДѓЃЌЙЪCДэЮѓЃЛ
DЁЂдіМгXЕФЮяжЪЕФСПЃЌXЕФХЈЖШдіДѓЃЌЦНКте§ЯђвЦЖЏЃЌXЕФзЊЛЏТЪНЕЕЭЃЌЙЪDДэЮѓЃЎ
ЙЪбЁBЃЎ
ЁОПМЕуОЋЮіЁПБОЬтжївЊПМВщСЫЛЏбЇЦНКтзДЬЌБОжЪМАЬиеїЕФЯрЙижЊЪЖЕуЃЌашвЊеЦЮеЛЏбЇЦНКтзДЬЌЕФЬиеїЃКЁАЕШЁБМД Vе§=VФц>0ЃЛЁАЖЏЁБМДЪЧЖЏЬЌЦНКтЃЌЦНКтЪБЗДгІШддкНјааЃЛЁАЖЈЁБМДЗДгІЛьКЯЮяжаИїзщЗжАйЗжКЌСПВЛБфЃЛЁАБфЁБМДЬѕМўИФБфЃЌЦНКтБЛДђЦЦЃЌВЂдкаТЕФЬѕМўЯТНЈСЂаТЕФЛЏбЇЦНКтЃЛгыЭООЖЮоЙиЃЌЭтНчЬѕМўВЛБфЃЌПЩФцЗДгІЮоТлЪЧДге§ЗДгІПЊЪМЃЌЛЙЪЧДгФцЗДгІПЊЪМЃЌЖМПЩНЈСЂЭЌвЛЦНКтзДЬЌЃЈЕШаЇЃЉВХФме§ШЗНтД№ДЫЬтЃЎ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЙЬЬхбљЦЗгЩNa2CO3КЭNaHCO3СНжжЪдМСзщГЩЃЌЯжШЁ27.4gИУбљЦЗжУгкЪдЙмжаЃЌГфЗжМгШШКѓИЩдяГЦжиЃЌЙЬЬхЕФжЪСПБфЮЊ21.2gЃЌЪдЧѓЃК
ЃЈ1ЃЉбљЦЗжаNaHCO3ЕФжЪСПЮЊ___________gЁЃ
ЃЈ2ЃЉЯђЗжНтКѓЕФЙЬЬхжаМгШы2molЁЄLЃ1ЕФбЮЫсЃЌЪЙжЎЭъШЋзЊЛЏЮЊNaClЃЌЫљашбЮЫсЕФЬхЛ§жСЩйЮЊ_______LЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЙигкЪЏгЭЕФЫЕЗЈВЛе§ШЗЕФЪЧ(ЁЁЁЁ)
A.ЪЏгЭжївЊКЌCЁЂHСНжждЊЫи
B.ЪЏгЭЭЈЙ§ДпЛЏжиећПЩЕУЕНЛЗзДЬў
C.ЪЏгЭСбЛЏЪЧЮяРэБфЛЏ
D.ЪЏгЭЗжСѓЕУЕНЕФЦћгЭЪЧЛьКЯЮя
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЗЯЫЎЫцвтХХЗХЛсдьГЩбЯжиЮлШОЃЌИљОнГЩЗжВЛЭЌПЩВЩгУВЛЭЌЕФДІРэЗНЗЈЃЎ
ЃЈ1ЃЉЕчГиЩњВњЙЄвЕЗЯЫЎжаГЃКЌгаCu2+ЕШжиН№ЪєРызгЃЌГЃгУFeSЕШФбШмЮяжЪзїЮЊГСЕэМСГ§ШЅЃЎвбжЊЪвЮТЯТKspЃЈFeSЃЉ=6.3ЁС10Љ18mol2LЉ2 ЃЌ KspЃЈCuSЃЉ=1.3ЁС10Љ36mol2LЉ2 ЃЎ ЂйЧыгУРызгЗНГЬЪНЫЕУїЩЯЪіГ§дгЕФдРэ ЃЎ
ЂкFeSИпЮТьбЩеВњЩњЕФSO2ЦјЬхЭЈШыЯТСаШмвКжаЃЌФмЙЛВњЩњГСЕэЕФЪЧЃЈЬюађКХЃЉ
AЃЎBaЃЈNO3ЃЉ2BЃЎBaCl2
CЃЎBaЃЈOHЃЉ2DЃЎШмгаNH3ЕФBaCl2ШмвК
ЂлвбжЊдЊЫидкИпМлЬЌЪБГЃБэЯжбѕЛЏадЃЌШєдкЫсадCuSO4ШмвКжаМгШывЛЖЈСПЕФNa2SO3КЭNaClШмвКЃЌМгШШЃЌЩњГЩCuClГСЕэЃЌдђЩњГЩCuClЕФРызгЗНГЬЪНЪЧ ЃЎ
ЃЈ2ЃЉЕчНтЗЈДІРэЫсадКЌИѕЗЯЫЎЃЈжївЊКЌгаCr2O72ЉЃЉЪБЃЌдкЗЯЫЎжаМгШыЪЪСПNaClЃЌвдЬњАхзївѕЁЂбєМЋЃЌДІРэЙ§ГЬжаДцдкШчЯТЗДгІCr2O72+6Fe2++14H+ЈT2Cr3++6Fe3++7H2OЃЌзюКѓCr3+вдCrЃЈOHЃЉ3аЮЪНГ§ШЅЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈЬюађКХЃЉ
A.бєМЋЗДгІЮЊFeЉ2eЉЈTFe2+
B.ЕчНтЙ§ГЬжаШмвКpHМѕаЁ
C.Й§ГЬжагаFeЃЈOHЃЉ3ГСЕэЩњГЩ
D.ЕчТЗжаУПзЊвЦ12 molЕчзгЃЌзюЖрга2mol Cr2O72ЉБЛЛЙд
ЃЈ3ЃЉЗЯАБЫЎПЩвдзЊЛЏГЩАБЃЌАБдйЩшМЦГЩМюадШМСЯЕчГиЃЎЭМЪЧИУШМСЯЕчГиЪОвтЭМЃЌВњЩњЕФXЦјЬхПЩжБНгХХЗХЕНДѓЦјжаЃЌaЕчМЋзїМЋЃЈЬюЁАе§ЁБЁАИКЁБЁАвѕЁБЛђЁАбєЁБЃЉЃЌЦфЕчМЋЗДгІЪНЮЊ ЃЎ 
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПFeCl2ЪЧвЛжжживЊЕФЮлЫЎДІРэМСЃЌОпгавзгыЫЎЗДгІЁЂвзБЛбѕЛЏЕФаджЪЁЃФГаЫШЄаЁзщдкЪЕбщЪвжажЦБИЮоЫЎFeCl2ВЂВтЖЈЦфДПЖШЃЌЩшМЦСЫШчЯТЪЕбщЃЈМаГжзАжУвбТдШЅЃЌIжаИїзАжУВЛжиИДЪЙгУЃЉЁЃ
ЂёЃЎFeCl2ЕФжЦБИ
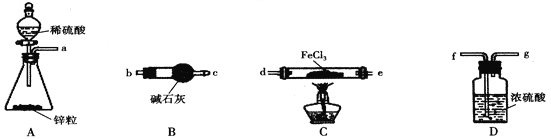
ЃЈ1ЃЉМгШШЬѕМўЯТЃЌH2гыFeCl3жЦБИЮоЫЎFeCl2ЕФЛЏбЇЗНГЬЪНЮЊ______________________ЁЃ
ЃЈ2ЃЉАДЦјСїДгзѓЕНгвЕФЗНЯђЃЌЩЯЭМжазАжУКЯРэЕФСЌНгЫГађЮЊ_________________ЃЈгУвЧЦїНгПкДІЕФзжФИБэЪОЃЉЁЃ
ЃЈ3ЃЉзАжУBЕФзїгУЮЊ____________ЁЃ
ЃЈ4ЃЉЗДгІНсЪјКѓЃЌгІЯШЯЈУ№CДІЕФОЦОЋЕЦЛЙЪЧЯШЙиБеAДІЗжвКТЉЖЗЕФЛюШћ_______________ЃЈЬюЁАЯЈУ№ОЦОЋЕЦЁБЛђЁАЙиБеЛюШћЁБЃЉЁЃ
ЂђЃЎFeCl2ЕФДПЖШВтЖЈ
вбжЊЃКЂйЪЕбщЕУЕНЙЬЬхЕФГЩЗжЮЊFeCl2КЭFeCl3ЁЃ
ЂкFe3ЃЋгыK3[FeЃЈCNЃЉ6]ВЛЗДгІЃЌ3Fe2ЃЋЃЋ2 [FeЃЈCNЃЉ6]3Ѓ![]() Fe3[FeЃЈCNЃЉ6]2Ё§ЁЃ
Fe3[FeЃЈCNЃЉ6]2Ё§ЁЃ
ИУаЫШЄаЁзщЩшМЦСЫШчЯТЪЕбщВтЖЈЕУЕНЕФFeCl2КЭFeCl3ЛьКЯЮяжаFeCl2ЕФДПЖШЁЃ
ЃЈiЃЉГЦШЁm gЗДгІКѓЕФЙЬЬхШмгкЙ§СПбЮЫсжаЃЌдйНЋЫљЕУШмвКМгЫЎЯЁЪЭЕН200 mLЁЃ
ЃЈiiЃЉзМШЗСПШЁ20 mLЩЯЪіШмвКгкЩеБжаЃЌМгШыЙ§СПЕФK3[FeЃЈCNЃЉ6]ШмвКЃЌгаРЖЩЋЕФFe3[FeЃЈCNЃЉ6]2ГСЕэЩњГЩЁЃ
ЃЈiiiЃЉЙ§ТЫЁЂЯДЕгЁЂИЩдяКѓНјааГЦСПЃЌЕУЕНW gРЖЩЋЙЬЬхЁЃ
ЃЈ5ЃЉВњЦЗжаFeCl2ЕФжЪСПЗжЪ§ЮЊ____________________________ЃЈгУКЌгаmКЭІиЕФЪНзгБэЪОЃЉЁЃМзЭЌбЇШЯЮЊАДееЩЯЪіЗНАИВтЕУЕФFeCl2ЕФжЪСПЗжЪ§ЦЋЕЭЃЌЫћЕФРэгЩЮЊ______________________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪжаЪєгкЕчНтжЪЕФЪЧ
A. SO2 B. (NH4)2SO4 C. Cl2 D. NaClШмвК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЕЅЮЛЪєгкЮяжЪЕФСПЕФЕЅЮЛЪЧ
A. ФІЖћ B. ПЫ C. Уы D. Щ§
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУМзЭщгыТШЦјЗЂЩњШЁДњЗДгІжЦШЁИБВњЦЗбЮЫсЕФЩшЯыдкЙЄвЕЩЯвбГЩЮЊЯжЪЕЁЃФГЛЏбЇаЫШЄаЁзщЭЈЙ§дкЪЕбщЪвжаФЃФтЩЯЪіЙ§ГЬЃЌЦфЩшМЦЕФФЃФтзАжУШчЯТЃК

ИљОнЩшМЦвЊЧѓЛиД№ЃК
ЃЈ1ЃЉBзАжУгаШ§жжЙІФмЃКЂйПижЦЦјСїЫйЖШЃЛЂкОљдШЛьКЯЦјЬхЃЛЂл________ЁЃ
ЃЈ2ЃЉЩшV(Cl2)/V(CH4)=xЃЌШєРэТлЩЯгћЛёЕУзюЖрЕФТШЛЏЧтЃЌдђxжЕгІ________ЁЃ
ЃЈ3ЃЉDзАжУЕФЪЏУожаОљдШЛьгаKIЗлФЉЃЌЦфзїгУЪЧ________________________________________ЁЃ
ЃЈ4ЃЉEзАжУЕФзїгУЪЧ____________(ЬюБрКХ)ЁЃ
AЃЎЪеМЏЦјЬх BЃЎЮќЪеТШЦј
CЃЎЗРжЙЕЙЮќ DЃЎЮќЪеТШЛЏЧт
ЃЈ5ЃЉдкCзАжУжаЃЌОЙ§вЛЖЮЪБМфЕФЧПЙтееЩфЃЌЗЂЯжгВжЪВЃСЇЙмФкБкгаКкЩЋаЁПХСЃВњЩњЃЌаДГіжУЛЛГіКкЩЋаЁПХСЃЕФЛЏбЇЗНГЬЪН____________________________________ЁЃ
ЃЈ6ЃЉEзАжУГ§ЩњГЩбЮЫсЭтЃЌЛЙКЌгагаЛњЮяЃЌДгEжаЗжРыГігаЛњЮяЕФзюМбЗНЗЈЮЊ________ЁЃИУзАжУЛЙгаШБЯнЃЌдвђЪЧУЛгаНјааЮВЦјДІРэЃЌЦфЮВЦјжївЊГЩЗжЮЊ______(ЬюБрКХ)ЁЃ
aЃЎCH4ЁЁ bЃЎCH3Cl ЁЁcЃЎCH2Cl2ЁЁ dЃЎCHCl3 ЁЁeЃЎCCl4
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШлШкбЮШМСЯЕчГиОпгаИпЕФЗЂЕчаЇТЪЃЌвђЖјЪмЕНжиЪгЃЌПЩгУLi2CO3КЭNa2CO3ЕФШлШкбЮЛьКЯЮязїЕчНтжЪЃЌCOЮЊбєМЋШМЦјЃЌПеЦјгыCO2ЕФЛьКЭЦјЮЊвѕМЋжњШМЦјЃЌжЦЕУдк650ЁцЯТЙЄзїЕФШМСЯЕчГиЃЌвбжЊЦфЕчГиЗДгІЯрЕБгкCOЕФШМЩеЃЌЧвИКМЋЗДгІЪНЮЊ2CO+2CO ![]() Љ4eЉ=4CO2
Љ4eЉ=4CO2
ЃЈ1ЃЉИУЕчГиЕФе§МЋЗДгІЪНЮЊЃЛ
ЃЈ2ЃЉШєгУИУШМСЯЕчГигыШчЭМзАжУСЌНгФЃФтЙЄвЕЕчНтЪГбЮЫЎЃЌдђЬњАєгІСЌНгЕчдДЕФЃЈЬюаДЁАе§МЋЁБЛђЁАИКМЋЁБЃЉЃЌЕчНтзмЗДгІЕФРызгЗНГЬЪНЮЊ ЃЎ ЕБЕчГиФкЭЈЙ§0.2mol ЕчзгЪБЃЌЕчНтзАжУжаСНМЋЙВЩњГЩЦјЬхLЃЈБъзМзДПіЯТЃЉЃЌДЫЪБНЋЕчНтвКГфЗжЛьКЯЃЌШмвКЕФpHЃЈВЛПМТЧШмвКЬхЛ§ЕФБфЛЏЃЉЃЎ
ЃЈ3ЃЉРћгУИУШМСЯЕчГизіЕчдДЃЌвдNiSO4ШмвКЮЊЕчНтжЪШмвКНјааДжФјЃЈКЌFeЁЂZnЁЂCuЁЂPtЁЂAuЕШдгжЪЃЉЕФЕчНтОЋСЖЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЬюДњКХЃЉЃЎЃЈвбжЊбѕЛЏадЃКFe2+ЃМNi2+ЃМCu2+ЃЉaЃЎЕчНтЙ§ГЬжаЃЌЛЏбЇФмзЊЛЏЮЊЕчФм bЃЎДжФјзїбєМЋЃЌЗЂЩњЛЙдЗДгІ
cЃЎРћгУбєМЋФрПЩЛиЪеCuЁЂPtЁЂAuЕШН№Ъє dЃЎДжФјОЋСЖЪБЭЈЙ§ЕФЕчСПгывѕМЋЮіГіФјЕФжЪСПГЩе§БШЃЎ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com