
【题目】下列说法正确的是
A.氨的催化氧化是一种特殊的固氮方式
B.工业冶炼铝:电解熔融AlCl3固体
C.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁
D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器通入两种气体后发生化学反应,反应中各物质的量变化如图所示,对该反应的推断合理的是( ) 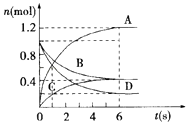
A.该反应的化学方程式为3B+4D═6A+2C
B.反应进行到6s时v(B)=v(C)
C.反应进行到6s时,用B表示的平均反应速率为0.05molL﹣1s﹣1
D.反应进行到6s时,反应停止了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干电池原理示意图如图,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是( )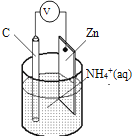
A.碳为电池的正极
B.Zn极上发生还原反应
C.常见锌锰干电池为二次电池
D.反应2NH4++2e﹣=2NH3↑+H2↑在负极上发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质或原子结构的递变,叙述不正确的是
A. Na、Mg、Al原子最外层电子数依次增多
B. P、S、Cl元素最高正化合价依次增大
C. Li、Na、K的电子层数依次增多
D. N、O、F得电子能力依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)工业上用FeCl3溶液刻蚀铜的线路板, 反应为Cu+2FeCl3=CuCl2+2FeCl2依据此氧化还原反应,设计成原电池.现给出铁棒、铜棒、石墨电极,原电池的负极为 , 正极电极反应方程式 , 若负极减重6.4克,则电路中转移电子的物质的量为 .
(2)在一密闭的2L的容器里装有4mol SO2和2mol O2 , 在一定条件下开始反应.2min末测得容器中共有5.6mol 气体,试计算: (i)2min末SO3的浓度 .
(ii)用SO2表示该反应的平均反应速率 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用.铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O.负极反应式为 . 正极反应式为 .
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为 , 若将此反应设计成原电池,则负极所用电极材料为 , 正极反应式为 .
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为 .
A.铝片、铜片
B.铜片、铝片
C.铝片、铝片
D.铜片、铜片
写出插入烧碱溶液中形成原电池的负极反应式: .
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是(填“a”或“b”),该极的电极反应式是: .
②电池工作一段时间后电解质溶液的pH(填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对比甲烷和乙烯的燃烧反应,下列叙述中正确的是( )
A. 二者燃烧时现象完全相同
B. 点燃前都不用验纯
C. 甲烷燃烧的火焰呈淡蓝色,乙烯燃烧的火焰较明亮
D. 二者燃烧时都有黑烟生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的提纯或离子检验的方法正确的是
A.用渗析的方法精制氢氧化铁胶体
B.以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜
C.除去KCl溶液中的少量MgCl2,加入过量KOH溶液,然后过滤即可
D.加入澄清石灰水,能产生白色沉淀,则原溶液中一定含有CO32—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com