
【题目】下列各物质的转化关系如下图所示,其中A是一种高熔点固体,D是一种红棕色固体。

回答下列问题:
(1)A的化学式为___________;J的化学式为________;G的化学式为________;C的化学式为___________;D的化学式为_________
(2)写出由A生成H的离子反应方程式:_________________________。
【答案】 Al2O3 Fe2(SO4)3 Fe(OH)3 Al Fe2O3 Al2O3+2OH-=2AlO2- +H2O
【解析】A是一种高熔点固体,电解熔融的A得到B和C。D是一种红棕色固体能与C反应生成A与E,A与强酸或强碱均反应,这说明该反应是铝热反应,因此A是氧化铝,B是氧气,C是铝,D是氧化铁,E是铁。氧化铝与强碱反应生成H是偏铝酸盐,与稀酸反应生成I是铝盐。铁与稀酸反应生成F,F中加入氨水并通入氧气生成G,所以F是亚铁盐,G是氢氧化铁,热分解生成氧化铁,氧化铁与稀硫酸反应生成J是硫酸铁。
(1)根据以上分析可知A的化学式为Al2O3;J的化学式为Fe2(SO4)3;G的化学式为Fe(OH)3;C的化学式为Al;D的化学式为Fe2O3;(2)由A生成H的离子反应方程式为Al2O3+2OH-=2AlO2-+H2O。


科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)+bB(g)mC(s)+nD(g)达到平衡后,保持温度不变,将容器体积减小为原来体积的 ![]() ,达到新的平衡时,D的浓度是原来的1.7倍,下列说法正确的是( )
,达到新的平衡时,D的浓度是原来的1.7倍,下列说法正确的是( )
A.物质B的转化率增大
B.平衡向正反应方向移动
C.物质A的体积分数增大
D.a+b>m+n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】遇到下列情况,处理得当的是( )
A. 不小心将少量浓硫酸沾到皮肤,立即用水冲洗。
B. 皮肤上沾有浓碱溶液时,立即用盐酸洗。
C. 为了避免浪费,应该把实验用剩的药品放回原试剂瓶中。
D. 连接并组装成套仪器时,一般按自上而下、从左到右的顺序进行安装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)2C(g)+D(s),已知将2molA和1molB
充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中体积分数为n%。
(1)若把2molA和1molB充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ(如图),则该反应的正反应是 反应。
(2)若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是
(3)若将原容器改为容积可变的容器,在一定温度和常压下,将2molA和1molB充入该容器中,建立平衡之后,B的物质的量浓度为a mol/L.
Ⅰ、现持续增大压强,当:
①当压强为原来1.5倍时,B的平衡时物质的量浓度为m mol/L,测得m<1.5a;
②当压强为原来10倍时,B的平衡时物质的量浓度为n mol/L,测得n>10a;
试解释形成第②种结果的可能原因是
Ⅱ、再将2molA和1molB充入该容器中,则反应速率(Y)与时间(X)关系图象可表示为 
(4)若维持该题原条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol.则D的起始物质的量n(D) 应满足的条件是 (用含有W的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在反应:2SO2(g)+O2(g)2SO3(g)的化学平衡体系中,SO2、O2、SO3的浓度分别为2molL﹣1、0.8molL﹣1、2.4molL﹣1 , 则O2在反应起始时可能的浓度范围是( )
A.0.8~2.0 molL﹣1
B.0~2.0 molL﹣1
C.0~0.8 molL﹣1
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO虽是大气污染物,但研究表明少量NO在人体内可参与神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的化学方程式为__________。
(2)某同学设计了如下图所示装置,研究铜丝与稀硝酸反应生成的气体确实是NO。
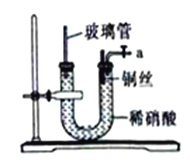
①反应开始后,可以观察到的现象是导管a处产生无色气体、_______。
②玻璃管的作用是_________。
③若需使反应停止.可采取的操作是________。
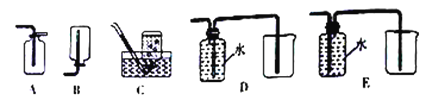
(3)如要在上图a管处连接收集NO气体的装置,合理的是______(填字母)。
(4)工业上利用氨气和氧气制取NO的方法是(填化学方程式)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种新近开发的固体氧化物燃料电池.它以掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体为固体电解质,在熔融状态下传导氧离子(O2﹣),其中多孔电极a、b均不参与电极反应.下列判断不正确的是( ) 
A.采用多孔电极的目的是易于吸附气体
B.有H2放电的b极为电池的负极
C.a极对应的电极反应为O2+2H2O+4e﹣=4OH﹣
D.b极对应的电极反应为2H2﹣4e﹣+2O2﹣=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是常见元素的物质转化关系图(部分物质被省略),A.D是常见金属单质,C是重要的耐火材料,G的水溶液中滴加KSCN呈红色。F 为两种元素组成的刺激性气体,是常见的大气污染物,其两种元素的质量比为1:1.少量F通入E溶液中产生白色沉淀H。M是红褐色固体。

(1)写出下列物质的化学式:A____________、E___________、F___________、G___________;
(2)写出下列反应的反应方程式(能写离子方程式的必须写离子方程式)
反应①____________________________________;
反应②____________________________________;
反应⑤____________________________________;
(3)K到M有两种方式可以实现
①加入氢氧化钠并敞放于空气中,此时可观察到的现象是_________________________________;
②只加入一种固体物质L直接实现,则L的化学式为:__________,若按n(K):n(L)=1:1加入,离子方程式为____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com