
【题目】NO虽是大气污染物,但研究表明少量NO在人体内可参与神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的化学方程式为__________。
(2)某同学设计了如下图所示装置,研究铜丝与稀硝酸反应生成的气体确实是NO。
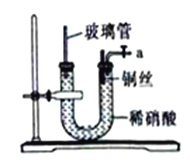
①反应开始后,可以观察到的现象是导管a处产生无色气体、_______。
②玻璃管的作用是_________。
③若需使反应停止.可采取的操作是________。
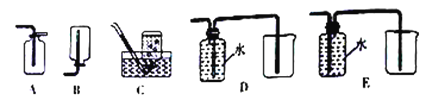
(3)如要在上图a管处连接收集NO气体的装置,合理的是______(填字母)。
(4)工业上利用氨气和氧气制取NO的方法是(填化学方程式)__________。
【答案】 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O U形管右侧溶液颜色变蓝(或铜丝部分溶解) 接收被气体压出U形管的液体 关闭铜丝附近导气管上的旋塞 C、D 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
【解析】(1)实验室用金属铜和稀硝酸反应生成硝酸铜、一氧化氮和水制取NO的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;(2)①反应开始后,可以观察到的现象是导管a处产生无色气体、U形管右侧溶液颜色变蓝或铜丝部分溶解;②玻璃管的作用是接收被气体压出U形管的液体;③关闭铜丝附近导气管上的旋塞,产生的气体将U形管右端的溶液排开,铜丝与溶液分开,反应停止;(3)一氧化氮能与空气中的氧气反应且能污染空气,不能用排空气法收集,不溶于水且不与水反应可以用排水法收集,故符合的收集装置有CD,答案选CD;(4)工业上利用氨气和氧气在催化剂的作用下加热反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。


科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)具有耐高温、抗冲击导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C![]() 2AlN+3CO,下列叙述正确的是
2AlN+3CO,下列叙述正确的是
A. 在氮化铝合成反应中,N2是还原剂,Al2O3是氧化剂
B. 氮化铝晶体熔沸点很低
C. 氮化铝中氮元素化合价为-3价
D. 上述反应中每生成2molAlN,N2得到3mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质的转化关系如下图所示,其中A是一种高熔点固体,D是一种红棕色固体。

回答下列问题:
(1)A的化学式为___________;J的化学式为________;G的化学式为________;C的化学式为___________;D的化学式为_________
(2)写出由A生成H的离子反应方程式:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol N2O5置于2L密闭容器中,在一定温度下发生下列反应: ①2N2O5(g)2N2O4(g)+O2(g);②N2O4(g)2NO2(g).达到平衡时,c(O2)=0.2molL﹣1 , c(NO2)=0.6molL﹣1 , 则此温度下反应①的平衡常数为( )
A.3.2
B.0.2
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】净水剂能够改善水质,给人们的生活、健康带来很大的益处。
(1) 明矾[KAl(SO4)2·12H2O]是常见的净水剂。其在水中的电离方程式为_______;明矾可净水是因为在天然水中生成胶状Al(OH)3,Al(OH)3具有____的作用。
(2)碱式氯化铝(简称BAC)是高效净水剂的主要成分。实验室模拟利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝[Al2(OH)nCl6-n]的过程如下:

①盐酸溶解铝土矿过程中,发生反应的离子方程式为_____________、_______;溶解过程中需不断搅拌,目的是________________。
②加适量铝粉的主要作用是_______________。
③蒸发浓缩所需玻璃仪器为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
(1)检验溶液中Fe3+存在的试剂是________,证明Fe3+存在的现象是________。
(2)写出FeCl3溶液与金属铜发生反应的离子方程式:________。
(3)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得纯净的FeCl3溶液,准备采用下列步骤:

请写出上述实验中加入或生成的有关物质的化学式。
①________,④________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为________。
①加入足量氯水②加入足量KMnO4溶液③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
(5)写出向②⑤的混合液中通入⑥的离子方程式:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com