
【题目】下列物质中属于非电解质的是( )
A. 乙醇溶液 B. SO2 C. Na2CO3 D. NaOH
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。( )
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是
A.0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B.Fe3+的作用是加快过氧化氢的分解速率
C.反应①是吸热反应、反应②是放热反应
D.反应2H2O2(aq) ![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温容器中加入1molN2和3molH2 , 达到平衡时NH3的体积分数为m%.若N2、H2、NH3的起始加入量分别为xmol、ymol、zmol,达到平衡时NH3的体积分数仍为m%.
(1)该容器恒容,则x、y、z应满足的关系是 .
(2)该容器恒压,则x、y、z应满足的关系是 .
(3)设前者达到平衡时生成NH3为amol,则后者达到平衡时生成NH3=mol(用a、x、z表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。

请回答下列问题:
(1)写出下列物质的化学式:B_________,丙_________,乙_________,H_________
(2)根据要求回答:
1)D溶液和F溶液在空气中混合的现象:_________________________________;
2)反应③离子方程式___________________________________________________;
3)反应⑦离子方程式___________________________________________________;
4)反应⑥化学方程式___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】遇到下列情况,处理得当的是( )
A. 不小心将少量浓硫酸沾到皮肤,立即用水冲洗。
B. 皮肤上沾有浓碱溶液时,立即用盐酸洗。
C. 为了避免浪费,应该把实验用剩的药品放回原试剂瓶中。
D. 连接并组装成套仪器时,一般按自上而下、从左到右的顺序进行安装。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积固定不变的密闭容器中进行反应:2A(g)+B(g)2C(g)+D(s),已知将2molA和1molB
充入该容器中,反应在某温度下达到平衡时,C的物质的量为Wmol,C在平衡混合气体中体积分数为n%。
(1)若把2molA和1molB充入该容器时,处于状态Ⅰ,达到平衡时处于状态Ⅱ(如图),则该反应的正反应是 反应。
(2)若降低原平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是
(3)若将原容器改为容积可变的容器,在一定温度和常压下,将2molA和1molB充入该容器中,建立平衡之后,B的物质的量浓度为a mol/L.
Ⅰ、现持续增大压强,当:
①当压强为原来1.5倍时,B的平衡时物质的量浓度为m mol/L,测得m<1.5a;
②当压强为原来10倍时,B的平衡时物质的量浓度为n mol/L,测得n>10a;
试解释形成第②种结果的可能原因是
Ⅱ、再将2molA和1molB充入该容器中,则反应速率(Y)与时间(X)关系图象可表示为 
(4)若维持该题原条件不变,仅从生成物开始配比,要求达到平衡时,C的物质的量仍为Wmol.则D的起始物质的量n(D) 应满足的条件是 (用含有W的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO虽是大气污染物,但研究表明少量NO在人体内可参与神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的化学方程式为__________。
(2)某同学设计了如下图所示装置,研究铜丝与稀硝酸反应生成的气体确实是NO。
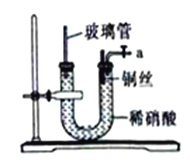
①反应开始后,可以观察到的现象是导管a处产生无色气体、_______。
②玻璃管的作用是_________。
③若需使反应停止.可采取的操作是________。
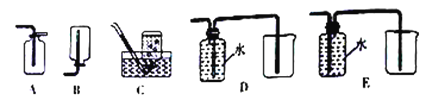
(3)如要在上图a管处连接收集NO气体的装置,合理的是______(填字母)。
(4)工业上利用氨气和氧气制取NO的方法是(填化学方程式)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考如图和有关要求回答问题: 
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2 . 图1是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是(填“增大”、“减小”、“不变”),反应热△H的变化是(填“增大”、“减小”、“不变”).
(2)以CH3OH燃料电池为电源电解法制取ClO2 . 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂. ①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH(填“增大”、“减小”、“不变”).负极反应式为 .
②图2中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2 . 阳极产生 ClO2的反应式为 .
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为mol.
(3)图2中电解池改为用石墨作电极,在一定条件下电解0.05molL﹣1的硫酸铜溶液200mL,当两极产生的气体体积相同时, ①发生电解的总反应方程式为
②若电解后溶液的体积还是200mL,溶液的pH=
③电解后加入下列固体物质可使溶液恢复到电解前
A CuO B Cu (OH)2C CuCO3D CuSO4 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com