
【题目】净水剂能够改善水质,给人们的生活、健康带来很大的益处。
(1) 明矾[KAl(SO4)2·12H2O]是常见的净水剂。其在水中的电离方程式为_______;明矾可净水是因为在天然水中生成胶状Al(OH)3,Al(OH)3具有____的作用。
(2)碱式氯化铝(简称BAC)是高效净水剂的主要成分。实验室模拟利用铝土矿(主要含Al2O3,还含少量Fe2O3及其他不溶杂质)制取碱式氯化铝[Al2(OH)nCl6-n]的过程如下:

①盐酸溶解铝土矿过程中,发生反应的离子方程式为_____________、_______;溶解过程中需不断搅拌,目的是________________。
②加适量铝粉的主要作用是_______________。
③蒸发浓缩所需玻璃仪器为_______________。
【答案】 KAl(SO4)2=K++A13++2SO42- 凝聚水中的悬浮物,并能吸附色素 Al2O3+6H+=2A13++3H2O Fe2O3+6H+=2Fe3++3H2O 加快反应速率 除去浊液中的H+和Fe3+ 酒精灯、玻璃棒
【解析】(1)KAl(SO4)2·12H2O]在水中的电离方程式为KAl(SO4)2=K++A13++2SO42-;明矾可净水是因为在天然水中生成胶状Al(OH)3,Al(OH)3具有凝聚水中的悬浮物,并能吸附色素的作用。(2)①盐酸溶解铝土矿过程中,氧化铝、氧化铁与盐酸均反应,反应的离子方程式为Al2O3+6H+=2A13++3H2O、Fe2O3+6H+=2Fe3++3H2O;溶解过程中需不断搅拌,目的是增大反应物的接触面积,加快反应速率。②要得到氯化铝溶液,就需要除去溶液中的铁离子以及氢离子,因此加适量铝粉的主要作用是除去浊液中的H+和Fe3+。③蒸发浓缩所需玻璃仪器为酒精灯、玻璃棒。


科目:高中化学 来源: 题型:
【题目】NO虽是大气污染物,但研究表明少量NO在人体内可参与神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的化学方程式为__________。
(2)某同学设计了如下图所示装置,研究铜丝与稀硝酸反应生成的气体确实是NO。
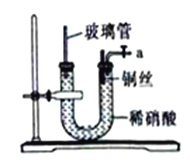
①反应开始后,可以观察到的现象是导管a处产生无色气体、_______。
②玻璃管的作用是_________。
③若需使反应停止.可采取的操作是________。
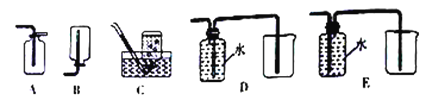
(3)如要在上图a管处连接收集NO气体的装置,合理的是______(填字母)。
(4)工业上利用氨气和氧气制取NO的方法是(填化学方程式)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种新近开发的固体氧化物燃料电池.它以掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体为固体电解质,在熔融状态下传导氧离子(O2﹣),其中多孔电极a、b均不参与电极反应.下列判断不正确的是( ) 
A.采用多孔电极的目的是易于吸附气体
B.有H2放电的b极为电池的负极
C.a极对应的电极反应为O2+2H2O+4e﹣=4OH﹣
D.b极对应的电极反应为2H2﹣4e﹣+2O2﹣=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的叙述不正确的是
A. 云、雾、烟都是胶体
B. 胶体和溶液的本质区别是能否产生丁达尔现象
C. “静电除尘”、“血液透析”都利用了胶体的性质
D. 胶体稳定存在的主要原因是胶粒带电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考如图和有关要求回答问题: 
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2 . 图1是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是(填“增大”、“减小”、“不变”),反应热△H的变化是(填“增大”、“减小”、“不变”).
(2)以CH3OH燃料电池为电源电解法制取ClO2 . 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂. ①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH(填“增大”、“减小”、“不变”).负极反应式为 .
②图2中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2 . 阳极产生 ClO2的反应式为 .
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为mol.
(3)图2中电解池改为用石墨作电极,在一定条件下电解0.05molL﹣1的硫酸铜溶液200mL,当两极产生的气体体积相同时, ①发生电解的总反应方程式为
②若电解后溶液的体积还是200mL,溶液的pH=
③电解后加入下列固体物质可使溶液恢复到电解前
A CuO B Cu (OH)2C CuCO3D CuSO4 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是常见元素的物质转化关系图(部分物质被省略),A.D是常见金属单质,C是重要的耐火材料,G的水溶液中滴加KSCN呈红色。F 为两种元素组成的刺激性气体,是常见的大气污染物,其两种元素的质量比为1:1.少量F通入E溶液中产生白色沉淀H。M是红褐色固体。

(1)写出下列物质的化学式:A____________、E___________、F___________、G___________;
(2)写出下列反应的反应方程式(能写离子方程式的必须写离子方程式)
反应①____________________________________;
反应②____________________________________;
反应⑤____________________________________;
(3)K到M有两种方式可以实现
①加入氢氧化钠并敞放于空气中,此时可观察到的现象是_________________________________;
②只加入一种固体物质L直接实现,则L的化学式为:__________,若按n(K):n(L)=1:1加入,离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A-K有如图所示转化关系,其中气体D、E为单质,试回答下列问题:
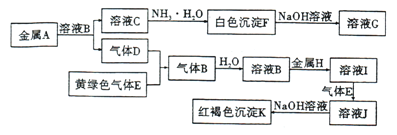
(1)写出下列物质的化学式:气体D是________,H是________.
(2)写出反应“I![]() J”的离子方程式:__________
J”的离子方程式:__________
(3)写出反应“F![]() G" 的离子方程式:____________
G" 的离子方程式:____________
(4)在溶液I中滴人NaOH溶液,可观察到的现象是_______其反应的原理是_________(写化学方程式)。
(5)检验溶液J中的金属阳离子,用_______试剂(填化学式),其现象是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com