
【题目】以NA表示阿伏加德罗常数的值,下列说法错误的是
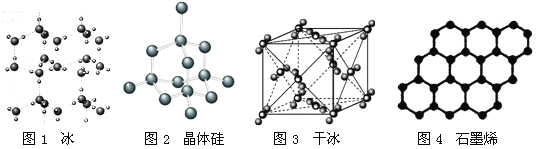
A. 18g冰(图1)中含O—H键数目为2NA
B. 28g晶体硅(图2)中含有Si—Si键数目为2NA
C. 44g干冰(图3)中含有NA个晶胞结构单元
D. 石墨烯(图4)是碳原子单层片状新材料,12g石墨烯中含C—C键数目为1.5NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是![]()
A.饱和氯水中滴加NaOH至溶液呈中性:![]()
B.100mL![]() 的
的![]() 溶液和200
溶液和200![]() 的
的![]() 溶液所含的
溶液所含的![]() 相同
相同
C.![]() 的一元酸和
的一元酸和![]() 的一元强碱等体积混合后的溶液;
的一元强碱等体积混合后的溶液;![]()
D.常温下,![]() 、浓度均为
、浓度均为![]() 。
。![]() 的
的![]() 、
、![]() COONa混合溶液
COONa混合溶液![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
(实验目的)制取乙酸乙酯。
(实验原理)甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,浓硫酸的作用是_________、_________。
(装置设计)甲、乙、丙三位同学分别设计了下列三套实验装置:
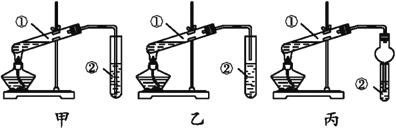
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,应选择的装置是____(填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是_________。
(实验步骤)
(1)按选择的装置组装仪器,在试管中先加入3 mL乙醇和2 mL冰醋酸,并在摇动下缓缓加入2 mL的浓硫酸;
(2)将试管固定在铁架台上;
(3)在试管②中加入适量的饱和Na2CO3溶液;
(4)用酒精灯对试管①加热;
(5)当观察到试管②中有明显现象时停止实验。
(问题讨论)
a.按步骤(1)装好实验装置,加入样品前还应检查__________;
b.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有_________;
c.试管②中饱和Na2CO3溶液的作用是________、________、________;
d.从试管②中分离出乙酸乙酯的实验操作是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由软锰矿浆(主要成分是MnO2)吸收含硫废渣产生的废气制备,工艺如下图所示。
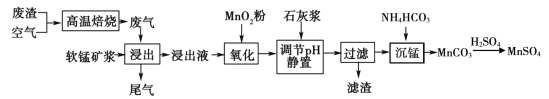
已知:浸出液的pH <2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。请回答下列问题:
(l)高温焙烧前需将矿石研成粉末,其目的是____。
(2)“氧化”中添加适量的MnO2的作用是____(用离子方程式表示);写出“沉锰”的离子方程式____。
(3)下列各组试剂中,能准确测定尾气中SO2含量的是____。(填编号)
a NaOH溶液、酚酞试液
b 稀H2SO4酸化的KMnO4溶液
c 碘水、淀粉溶液
d 氨水、酚酞试液
(4)滤渣的主要成分有____。
(5)若要从MnSO4溶液中得到高纯硫酸锰必须进行的实验操作顺序是____(用字母填空)。
a 过滤洗涤 b 蒸发浓缩 c 冷却结晶 d 干燥
(6)已知:![]() pH =7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10 -6mol/L),需调节溶液pH范围为____
pH =7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10 -6mol/L),需调节溶液pH范围为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
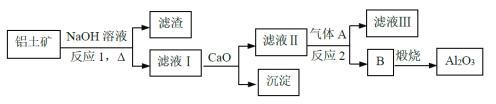
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
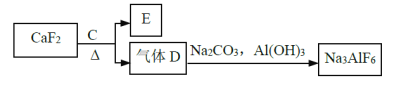
请回答下列问题:
(1)反应1中的化学方程式有2NaOH+SiO2→Na2SiO3+H2O以及___________;
(2)滤液Ⅰ中加入CaO生成的沉淀是_______,反应2的离子方程式为________(气体A过量);
(3)E可作为建筑材料,化合物C是浓硫酸,请写出由D制备冰晶石的化学方程式______;
(4)电解制铝以石墨为电极,请写出阳极的电极反应式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一端呈螺旋状的铜丝放在酒精灯上加热,铜丝表面生成黑色的___,再迅速把铜丝插入成盛有乙醇的试管中,看到铜丝表面___,反复多次,试管中有带___气味的___生成;所涉及反应的化学方程式为___,反应中乙醇被___(填“氧化”或“还原”),铜丝的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuO有氧化性,能被NH3还原,为验证此结论,设计如下实验。
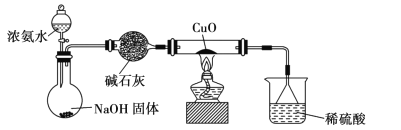
有关该实验的说法正确的是
A.反应时生成一种无污染的气体NO
B.NH3与CuO反应后生成的红色物质可能是Cu
C.装浓氨水的装置名称是分液漏斗,只能用作分液操作
D.烧杯中硫酸的作用是防倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作或实验现象的解释(方程式)正确的是
A.除去Na2CO3溶液中的Na2SO4,加入适量Ba(OH)2溶液后,过滤:Ba2++![]() =BaSO4↓
=BaSO4↓
B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2=Ag2S↓+2Cl
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2=2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀: 2![]() +Ca2++2OH=CaCO3↓+
+Ca2++2OH=CaCO3↓+![]() +2H2O
+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com