
【题目】甲醇是应用广泛的化工原料和前景乐观的无色液体燃料。请按要求回答下列问题。
(1)已知25℃、101 kpa时一些物质的燃烧热如下表:
物质 | CH3OH(l) | CO(g) | H2(g) |
燃烧热/(kJ/mol) | 726.8 | 283.0 | 285.8 |
写出由CO和H2反应生成CH3OH(l)的热化学方程式: _________________________。
(2)一定温度下,在容积为2L的恒容密闭容器中进行反应:CO(g)+2H2(g)=CH3OH(g),其相关数据如图所示。

①从反应开始至5min时,用CH3OH表示的反应平均速度为____________。
②图中反应达平衡时,K=_______(mol/L)-2;CO的平衡转化率为________________。
(3)人们利用甲醇制得能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,该装置工作时,a极反应式为____________________。

若用该电池及惰性电极电解2L饱和和食盐水产生224mL(标准误差2)Cl2时(假设全部句逸出并收集,忽略溶液体积的变化),常温下所得溶液的pH为________。
(4)甲醇在一定条件下可转化为甲酸。常温下,向0.1mol/L HCOOH溶液中滴加0.1mol/LNaOH溶液至pH=7[已知,K(HCOOH)=1.8×10-4]。此时混合游学中两溶质的物质的量之比n(HCOOH):n(HCOONa)____________。
【答案】CO(g)+2H2(g)=CH3OH(l) △H=-127.7kJ/mol 0.02mol/(Lmin) 9.375或![]() 60% CH3OH-6e-+H2O=CO2↑+6H+ 12 1:1800
60% CH3OH-6e-+H2O=CO2↑+6H+ 12 1:1800
【解析】
(1)先写出三个反应的热化学方程式,然后根据盖斯定律,将它们叠加,就可得到所需反应的热化学方程式;
(2)①根据V=![]() 计算化学反应速率;
计算化学反应速率;
②根据化学平衡常数K=![]() ,根据物质的转化率等于转化率与投入量的比值计算;
,根据物质的转化率等于转化率与投入量的比值计算;
(3)通入甲醇的电极为负极,失去电子,结合电解质溶液呈酸性书写电极反应式;先写出电解方程式,然后根据NaOH、Cl2的物质的量关系,结合溶液的体积计算pH;
(4)NaOH与HCOOH发生中和反应产生HCOONa和水,根据溶液的pH及HCOOH的电离平衡常数计算溶液中n(HCOOH):n(HCOONa)。
(1) ①CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol;
O2(g)=CO2(g) △H=-283.0kJ/mol;
②H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol;
O2(g)=H2O(l) △H=-285.8kJ/mol;
③CH3OH(l)+![]() O2(g)= CO2(g)+2H2O(l) △H=-726.8kJ/mol;
O2(g)= CO2(g)+2H2O(l) △H=-726.8kJ/mol;
①+2×②-③,整理可得:CO(g)+2H2(g)=CH3OH(l) △H=-127.7kJ/mol;
(2)①V=![]() =0.02mol/(Lmin);
=0.02mol/(Lmin);
②CO(g)+2H2(g)![]() CH3OH(l)
CH3OH(l)
根据化学方程式可得其化学平衡常数K==![]() =9.375;
=9.375;
CO的平衡转化率![]() =60%;
=60%;
(3)a电极通入甲醇,失去电子,发生氧化反应,由于是酸性环境,所以CH3OH失去电子变为CO2气体,电极反应式为CH3OH-6e-+H2O=CO2↑+6H+;用惰性电极电解NaCl饱和溶液的方程式为:2NaCl+H2O![]() 2NaOH+H2↑+Cl2↑,n(NaOH)=2n(Cl2)=2×
2NaOH+H2↑+Cl2↑,n(NaOH)=2n(Cl2)=2×![]() =0.02mol,c(NaOH)=
=0.02mol,c(NaOH)=![]() =0.01mol/L,c(H+)=
=0.01mol/L,c(H+)=![]() =10-12mol/L,所以溶液的pH=12;
=10-12mol/L,所以溶液的pH=12;
(4)HCOOH是一元弱酸,在溶液中存在电离平衡:HCOOH![]() HCOO-+H+,该反应的电离平衡常数K=
HCOO-+H+,该反应的电离平衡常数K=![]() =1.8×10-4,
=1.8×10-4,![]() =1.8×103,所以可得
=1.8×103,所以可得![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:Pb+PbO2 +2H2SO4=2PbSO4+2H2O,据此判断:
①铅蓄电池的负极材料是________(写化学式);
②工作时正极反应为__________________________________________;
③工作时,电解质溶液中阴离子移向________极(填“正”或“负”)。
(2)如图A 直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:

①电源A上的a为________极(填“正”或“负”);
②滤纸B上发生的总化学方程式为___________________;
③欲在电槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极f上发生的反应为________________________。电槽中放的镀液可以是___________(只需写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 Q、R、T、W 在元素周期表中的位置如图所示,其中 T 所处的周期数与主族序数相等。
![]()
(1)W 在周期表中的位置是_______,Q、R、T 三种元素原子半径由大到小的顺序为_______________________(用元素符号表示),Q 的最高价氧化物的化学式为________________,
(2)元素的原子得电子 能力:Q________________W(填“强于”或“弱于”)。
(3)原子序数比 R 多 1 的元素有一种氢化物能分解为它的另一种氢化物,该反应的化学方程式为______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图所示。R原子最外层电子数Q原子最外层电子数的4倍,Q的简单离子核外电子排布与Z2-相同。下列相关叙述不正确的是

A. 化合物![]() 中含有离子键
中含有离子键
B. 五种元素中Q的金属性最强
C. 气态氢化物的稳定性:![]()
D. 最高价氧化物对应的水化物酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
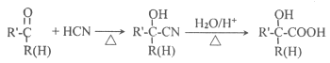
【题目】主要用于高分子胶囊和印刷油墨的粘合剂的甲基两烯酸缩水油酯GMA(即:![]() )的合成路线如下(部分反应所需试剂和条件已略去):
)的合成路线如下(部分反应所需试剂和条件已略去):

已知:
请按要求回答下列问题:
(1)GMA的分子式______________________;B中的官能团名称:______________________;甘油的系统命名:______________________。
(2)验证D中所含官能团各类的实验设计中,所需试剂有______________________。
(3)写出下列反应的化学方程式:反应⑤:____________________。反应⑧:______________________。
(4)M是H的同分异构体。M有多种同分异构体,写出满足下述所有条件的M的所有可能的结构:____________________________。
①能发生银镜反应 ②能使溴的四氯化碳溶液褪色 ③能在一定条件下水解
(5)已知: { 2 }![]()
![]()
![]() 。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:丙烯
。参照上述合成路线并结合此信息,以丙烯为原料,完善下列合成有机物C的路线流程图:丙烯![]() Br
Br![]() ________________________。
________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下6.72LHCl溶于水配成100mL溶液,取该溶液40mL与一定量的碳酸钙恰好完全反应。计算:
(1)此盐酸的物质的量浓度。(写出计算过程,下同)_____________________
(2)参与反应的碳酸钙的质量是多少?_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将![]() 溶液分别滴加到浓度均为
溶液分别滴加到浓度均为![]() 的
的![]() 溶液中,所得的沉淀溶解平衡曲线如图所示(
溶液中,所得的沉淀溶解平衡曲线如图所示(![]() 用
用![]() 表示,不考虑
表示,不考虑![]() 的水解)。下列叙述正确的是( )。
的水解)。下列叙述正确的是( )。

A. ![]() 的数量级为
的数量级为![]()
B. ![]() 点对应的
点对应的![]() 溶液为不饱和溶液
溶液为不饱和溶液
C. 所用![]() 溶液的浓度为
溶液的浓度为![]()
D. ![]() 平衡常数为
平衡常数为![]() ,反应趋于完全
,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下有机物:
① ![]() ②
② ![]() ③
③ ![]() ④ CH2=CH2 ⑤CH3—CH2Br
④ CH2=CH2 ⑤CH3—CH2Br
(1)能与![]() 溶液反应的有(填序号作答,以下同);______________________________
溶液反应的有(填序号作答,以下同);______________________________
(2)能与银氨溶液反应的有______________________________
(3)既能发生消去反应,又能发生酯化反应的有______________________________
(4)能发生氧化反应的有(除燃烧以外)______________________________
(5)能发生加成反应的是______________________________
(6)即能发生水解反应,又能发生消去反应的是____________
(7)乙烯生成聚乙烯反应方程式___________________________反应类型__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. ![]() =1×10-12的溶液:Na+、K+、ClO-、CO32-
=1×10-12的溶液:Na+、K+、ClO-、CO32-
B. 滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32-
C. 能溶解Al(OH)3的溶液:K+、NH4+、NO3—、CH3COO—
D. 0.1mol/LFe(NO3)2溶液:H+、Cu2+、SO42—、Cl—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com