
【题目】固体X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生如图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为气体混合物,R是一种无色无味能使澄清石灰水变浑浊的气体,C为红褐色沉淀,M为一种常见金属单质。

试回答下列问题:
(1)X的化学式为__________。
(2)实现G→H,欲不引进新的杂质,N可以选择下列物质中的_________(填序号)。
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)写出下列转化的化学方程式:
B→D:____________________;H→C:____________________。
(4)已知P中有一种气体与氢氧化钠溶液反应可生成两种正盐,该反应的离子方程式为:___________。
(5)X与浓硝酸在一定条件下反应时,若有1 mol X被氧化时,转移的电子数目为__________。
【答案】 Fe3C ③④ 3Fe+4H2O(g) ![]() Fe3O4 +4H2 3NH3·H2O +FeC13=Fe(OH)3↓+3NH4Cl 2NO2+2OH-=NO2-+NO3-+H2O 13NA
Fe3O4 +4H2 3NH3·H2O +FeC13=Fe(OH)3↓+3NH4Cl 2NO2+2OH-=NO2-+NO3-+H2O 13NA
【解析】根据题各物质转化关系,R是无色无昧且能使澄清石灰水变浑浊的气体,判断为CO2,则F应为碳酸盐,则P中应含有碳元素,C为红褐色沉淀为Fe(OH)3,则A和H中都含有铁离子,所以A为Fe(NO3)3,固体X是由两种常见元素组成的化合物,判断一定含有铁元素和碳元素,其中金属元素与另一元素的质量比为14:1.则X化学式为Fe3C,根据元素守恒,B中应含有氢元素,则依据M为常见金属单质,与B反应生成Q和D,所以B为H2O,Q为H2,H含有铁元素判断,M为金属Fe,D为Fe3O4,D与盐酸反应生成G为FeCl2和FeCl3,N为Cl2,G与N反应生成H为FeCl3,C加热生成E为Fe2O3,X与浓硝酸反应生成混合气体P应为CO2、NO2。
(1)根据上面的分析可知,X的化学式为Fe3C,故答案为:Fe3C;
(2)实现FeCl2→FeCl3,欲不引进新的杂质,N可以用H2O2或Cl2,故选③④;
(3)M为金属Fe,水和铁在高温反应的化学方程式为3Fe+4H2O![]() Fe3O4+4H2,氯化铁与氨水反应生成氢氧化铁沉淀,反应的化学方程式为3NH3·H2O +FeC13=Fe(OH)3↓+3NH4Cl ,故答案为:3Fe+4H2O
Fe3O4+4H2,氯化铁与氨水反应生成氢氧化铁沉淀,反应的化学方程式为3NH3·H2O +FeC13=Fe(OH)3↓+3NH4Cl ,故答案为:3Fe+4H2O![]() Fe3O4+4H2;3NH3·H2O +FeC13=Fe(OH)3↓+3NH4Cl;
Fe3O4+4H2;3NH3·H2O +FeC13=Fe(OH)3↓+3NH4Cl;
(4)P为CO2、NO2,P中有一种气体与氢氧化钠溶液反应可生成两种正盐,则该反应为二氧化氮与氢氧化钠反应生成硝酸钠和亚硝酸钠,反应的离子方程式为2NO2+2OH-=NO2-+NO3-+H2O,故答案为:2NO2+2OH-=NO2-+NO3-+H2O;
(5) X为Fe3C,与浓硝酸在一定条件下反应时,生成硝酸铁和二氧化碳,则1 mol Fe3C被氧化时,假设铁元素的化合价为0价,则反应后铁由0价变成+3价,C由0价变成+4价,转移的电子的物质的量为3×3+4=14mol,数目为13NA,故答案为:13NA。


科目:高中化学 来源: 题型:
【题目】对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是
A.K+、Na+、Cl-、NO3- B.Na+、NO3-、OH-、CO32-
C.Na+、OH-、Cl-、NO3- D.MnO4-、K+、S2-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
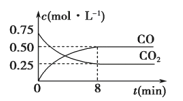
(1)该反应的平衡常数表达式K=____________。
(2)下列措施中能使平衡常数K增大的是__________(填序号)
A.升高温度 B.增大压强 C.充入一定量CO D.降低温度
(3)8 min内,CO的平均反应速率v(CO)=____________mol·L-1·min-1。
(4)1 100 ℃时,2 L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 3 mol Fe、2 mol CO2 | 4 mol FeO、3 mol CO |
CO的浓度(mol·L-1) | c1 | c2 |
CO2的体积分数 | φ1 | φ2 |
体系压强(Pa) | p1 | p2 |
气态反应物的转化率 | α1 | α2 |
①下列说法正确的是____________。
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=____________、φ1=____________、α2=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3=4N2↑+2HNO3+9H2O
则被氧化和被还原的氮元素质量之比为_____________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:__________________。
处理CN一还常用的一种方法是:用ClO一氧化处理生成CNO一,反应的离子方程式如下;
aCN-+bClO-+ 2cOH一=dCNO-+eN2↑+fCO32-+bCl-+cH2O
上述化学方程式可能的配平化学计量数有多组,回答下列问题:
①方程式中e:f的值为_________(填字母);
A.1 B.1/2 C.2 D.不能确定
②若d=e=l,则b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将pH=1的盐酸平均分成2份,1份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为
A. 12:l B.1l:1 C.10:1 D.9:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是
cZ(g)+dW(g)反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,W的浓度为原平衡状态的1.8倍。下列叙述正确的是
A.平衡向正反应方向移动 B.a+b > c+d
C.Z的体积分数变大 D.X的转化率变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Cu(NO3)2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制 AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:___。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g),已知某些化学键的键能数据如下表:
CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
键能/ kJ·mol-1 | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题
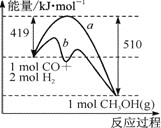
①该反应的ΔS____(填“>”或“<”)0。右图中曲线a到曲线b的措施是_______。
②已知CO中的C与O之间为三键,其键能为xkJ·mol-1,则x=____。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。①该电池负极的电极反应式为__。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42- |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。
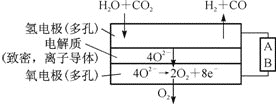
(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2,O2穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由上图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com