
【题目】一定条件下铁可以和CO2发生反应:
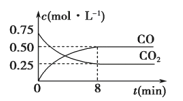
Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
(1)该反应的平衡常数表达式K=____________。
(2)下列措施中能使平衡常数K增大的是__________(填序号)
A.升高温度 B.增大压强 C.充入一定量CO D.降低温度
(3)8 min内,CO的平均反应速率v(CO)=____________mol·L-1·min-1。
(4)1 100 ℃时,2 L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 3 mol Fe、2 mol CO2 | 4 mol FeO、3 mol CO |
CO的浓度(mol·L-1) | c1 | c2 |
CO2的体积分数 | φ1 | φ2 |
体系压强(Pa) | p1 | p2 |
气态反应物的转化率 | α1 | α2 |
①下列说法正确的是____________。
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=____________、φ1=____________、α2=____________。
【答案】(1)![]() (2)A(3)0.0625
(2)A(3)0.0625
(4)①BC ②0.67 mol·L-1;33.3% ;33.3%
【解析】
试题分析:(1)Fe(s)+CO2(g)![]() FeO(s)+CO(g),依据平衡常数概念书写,注意固体和纯液体不写入表达式,表达式为:K=
FeO(s)+CO(g),依据平衡常数概念书写,注意固体和纯液体不写入表达式,表达式为:K= ![]() 。
。
(2)平衡常数随温度变化,不随浓度压强等因素变化,反应是吸热反应,升温平衡时K增大;A.升高温度,平衡正向进行,平衡常数增大,故A正确;B.增大压强,平衡不动,平衡常数不变,故B错误;C.充入一定量CO,平衡逆向进行,但平衡常数不变,故C错误;D.降低温度,平衡逆向进行,平衡常数减小,故D错误。故答案为:A;
(3)依据图象分析,8分钟内,一氧化碳浓度变化0.5mol/L,CO的平均反应速率v(CO)=△c/△t=0.5mol/L÷8min=0.0625mol/Lmin。故答案为:0.0625;
(4)①依据图表数据分析,反应前后气体体积不变,加入2molCO2,加入3mol CO,相当于加入3molCO2,平衡时气体体积分数相同,物质的量不同,压强不同,气体物质的量大的容器中压强大,起始量不同,平衡浓度、转化率不同。A.达到平衡状态,一氧化碳的浓度关系为:3c1=2c2,故A错误;B.反应物和生成物都是一种,平衡常数相同,所以达到平衡状态二氧化碳的体积分数相同,φ1=φ2,故B正确;C.乙容器中气体物质的量大于甲容器,所以达到平衡状态p1<p2,故C正确;D.起始量不同,甲容器正向进行,乙容器逆向进行,反应前后气体体积不变,气态反应物的转化率不相同,故D错误。故答案为:BC;
②图象分析反应在1100°C反应的平衡常数K=0.50/0.25=2
甲容器中设反应的二氧化碳浓度为x
Fe(s)+CO2(g)![]() FeO(s)+CO(g),
FeO(s)+CO(g),
起始量(mol/L)1 0
变化量(mol/L)x x
平衡量(mol/L)1-x x
K=x/(1-x)=2,解得x=2/3mol/L
平衡状态一氧化碳的浓度=2/3mol/L=0.67mol/L,
CO2的体积分数φ1=(1-x)/1×100%=1/3×100%=33.3%;
乙容器中温度和甲容器相同,平衡常数相同,所以二氧化碳的体积分数φ2=φ1 =33.3%。
故答案为:0.67molL-1 33.3% 33.3%。


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】(1)2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空。火箭使用偏二甲肼【(CH3)2N- NH2】和四氧化二氮【N2 O4】作为燃料。化学反应热量变化图象如图所示:

此反应的热化学方程式为: 。
(2)已知下列反应的反应热:
CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=-870.3kJ/mol
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ/mol
H2(g)+O2(g)=H2O(l) ΔH3=-285.8kJ/mol
试计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH= kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.石油裂解和油脂皂化都是由高分子生成小分子的过程
B.丙烯分子中所有原子不可能在同一平面上
C.(CH3)3CCH2CH3的一氯代物有3种
D.甲苯的硝化、乙酸乙酯的水解均可看作取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物…—CH2—CH2—CH2—…是用下列何种物质聚合成的( )
A. CH3—CH3 B. CH3—CH2—CH3
C. CH2=CH2 D. CH2=CH—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 含有NA个原子的氢气在标准状况下的体积约为22.4 L
B. 标准状况下,11.2 L SO3含有的分子数为0.5NA
C. 40gNaOH溶解在1L水中,所制得的100 mL溶液中含Na+数为0.1NA
D. 25℃、1.01×lO5 Pa,64 g SO2中含有的原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图的叙述正确的是
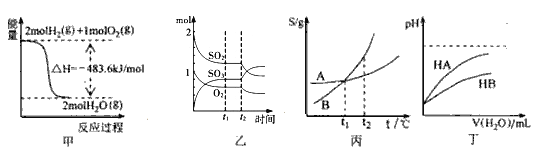
A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJmol-1
B. 图乙表示一定条件下进行的反应2SO2+O2![]() 2SO3各成分的物质的量变化,t2时刻改变的条件一定是缩小容器体积
2SO3各成分的物质的量变化,t2时刻改变的条件一定是缩小容器体积
C. 图丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(B)>ω(A)
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在空气中直接蒸发下列盐的溶液:①Fe2(SO4)3 ②Na2CO3 ③KC1 ④CuCl2 ⑤NaHCO3可以得到相应盐的晶体(可以含有结晶水)的是( )
A.①③⑤ B.①②③ C.②④ D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体X是由两种常见元素组成的化合物,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生如图的转化关系,有的反应标出全部产物,有的反应标出部分产物。已知P为气体混合物,R是一种无色无味能使澄清石灰水变浑浊的气体,C为红褐色沉淀,M为一种常见金属单质。

试回答下列问题:
(1)X的化学式为__________。
(2)实现G→H,欲不引进新的杂质,N可以选择下列物质中的_________(填序号)。
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)写出下列转化的化学方程式:
B→D:____________________;H→C:____________________。
(4)已知P中有一种气体与氢氧化钠溶液反应可生成两种正盐,该反应的离子方程式为:___________。
(5)X与浓硝酸在一定条件下反应时,若有1 mol X被氧化时,转移的电子数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电导率传感器可绘制电导率曲线图,下图为用0.1mol·L-1NaOH溶液滴定10mL,0.1mol·L-1盐酸过程中的电导率曲线。下列说法错误的是

A. 电导率传感器能用于判断酸碱中和滴定的终点
B. 该过程中,a点所示溶液的导电性最强
C. c点电导率最小是因为此时溶液中导电微粒的数目最少
D. d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com