
【题目】高聚物…—CH2—CH2—CH2—…是用下列何种物质聚合成的( )
A. CH3—CH3 B. CH3—CH2—CH3
C. CH2=CH2 D. CH2=CH—CH3
科目:高中化学 来源: 题型:
【题目】对四种无色溶液进行离子检验,实验结果如下,其中明显错误的是
A.K+、Na+、Cl-、NO3- B.Na+、NO3-、OH-、CO32-
C.Na+、OH-、Cl-、NO3- D.MnO4-、K+、S2-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,实现铅的再生利用。其工作流程如下:
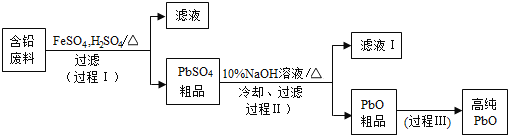
(1)过程Ⅰ中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是_________。
(2)过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++SO42-═2Fe3++PbSO4+2H2O
ii:……
①写出ii的离子方程式:______________________。
②下列实验方案可验证上述催化过程.将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2,溶液变红。
b.____________。
(3)PbO溶解在NaOH溶液中,其溶解度曲线如图1所示。

①过程Ⅱ的目的是脱硫。滤液1经处理后可在过程Ⅱ中重复使用,其目的是___(选填序号)。
A.减小PbO的损失,提高产品的产率
B.重复利用NaOH,提高原料的利用率
C.增加Na2SO4浓度,提高脱硫效率
②过程Ⅲ的目的是提纯,结合上述溶解度曲线,简述过程Ⅲ的操作:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,1 100 ℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示。
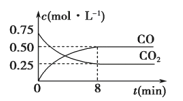
(1)该反应的平衡常数表达式K=____________。
(2)下列措施中能使平衡常数K增大的是__________(填序号)
A.升高温度 B.增大压强 C.充入一定量CO D.降低温度
(3)8 min内,CO的平均反应速率v(CO)=____________mol·L-1·min-1。
(4)1 100 ℃时,2 L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 3 mol Fe、2 mol CO2 | 4 mol FeO、3 mol CO |
CO的浓度(mol·L-1) | c1 | c2 |
CO2的体积分数 | φ1 | φ2 |
体系压强(Pa) | p1 | p2 |
气态反应物的转化率 | α1 | α2 |
①下列说法正确的是____________。
A.2c1=3c2 B.φ1=φ2 C.p1<p2 D.α1=α2
②求c1=____________、φ1=____________、α2=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3=4N2↑+2HNO3+9H2O
则被氧化和被还原的氮元素质量之比为_____________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:__________________。
处理CN一还常用的一种方法是:用ClO一氧化处理生成CNO一,反应的离子方程式如下;
aCN-+bClO-+ 2cOH一=dCNO-+eN2↑+fCO32-+bCl-+cH2O
上述化学方程式可能的配平化学计量数有多组,回答下列问题:
①方程式中e:f的值为_________(填字母);
A.1 B.1/2 C.2 D.不能确定
②若d=e=l,则b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) ΔH=+84 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:___。
(2)工业上可用如下方法合成甲醇,化学方程式为CO(g)+2H2(g)![]() CH3OH(g),已知某些化学键的键能数据如下表:
CH3OH(g),已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | O—H |
键能/ kJ·mol-1 | 348 | 413 | 436 | 358 | x | 463 |
请回答下列问题
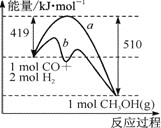
①该反应的ΔS____(填“>”或“<”)0。右图中曲线a到曲线b的措施是_______。
②已知CO中的C与O之间为三键,其键能为xkJ·mol-1,则x=____。
(3)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。①该电池负极的电极反应式为__。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl | SO42- |
c/mol·L-1 | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件下)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____。
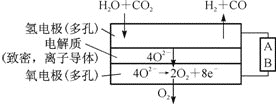
(4)电解水蒸气和CO2产生合成气(H2+CO)。较高温度下(700~1 000℃),在SOEC两侧电极上施加一定的直流电压,H2O和CO2在氢电极发生还原反应产生O2,O2穿过致密的固体氧化物电解质层到达氧电极,在氧电极发生氧化反应得到纯O2。由上图可知A为直流电源的____(填“正极”或“负极”),请写出以H2O为原料生成H2的电极反应式:_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com