
����Ŀ�����մ�Na2S2O35H2O�����մ��С�մ�Ϊ�մ����ֵܣ������������������й㷺��Ӧ�á�
��1����ҵ�ϣ���̼���ƺ����������ʵ���1:2��������Һ����ͨ��SO2����ȡNa2S2O3��ͬʱ�ų�CO2��д���˷�Ӧ�Ļ�ѧ��Ӧ����ʽ___��������Һ�ڿ����о��û���ֵ���ɫ���ʣ����ⶨ�����ʾ���������������ƵĽṹ�������ʵĵ���ʽΪ��___��
��2��Na2S2O3����Һ�����ڵζ�I2�ĺ��������ζ���Һ�����Իᵼ�²ⶨ���ƫ�ߣ������ӷ���ʽ������ԭ��____��
��3����ҵ�ϳ��ô��մ���Һ���չ�ҵβ���е�Cl2������������ΪSO42-����д�������ӷ���ʽ��___��������һ���Լ����Լ��÷�Ӧ�Ƿ��ѷ�����Ӧ����___��
A.AgNO3+HNO3(ϡ) B.BaCl2+HCl C.Ʒ��+H2SO4(ϡ) D.HCl+����ʯ��ˮ
��4�����ܱ�������Ͷ��һ������Na2O2��NaHCO3��300���³�ַ�Ӧ������������Ϊ���������ʼʱn(NaHCO3)/n(Na2O2)�������������Ϊ___��
���𰸡�Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2 ![]() S2O32-+2H+=S��+SO2��+H2O S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ B ��2
S2O32-+2H+=S��+SO2��+H2O S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ B ��2
��������
(1)������ɿ�֪Na2CO3��Na2S��1:2�����ʵ���֮�Ȼ�ϣ���ͨ�������������Ӧ����Na2S2O3�Ͷ�����̼������ԭ�Ӹ����غ㡢��ʧ�����غ���д����ʽ�����ݹ������ƽṹ�����ԭ�ӡ���ԭ�ӽṹ���
(2)���Ի�����S2O32-�����绯��Ӧ�����ĵ�����������ƫ�࣬�ⶨ�����ƫ�ߣ�
(3)��ҵ���ô��մ���Һ���չ�ҵ�����е�����������������ΪSO42-�����ӷ�Ӧ����ʽΪ��S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+��ֻҪ������Һ�к���SO42-����˵����Ӧ�Ѿ�������
(4)Na2O2��������NaHCO3��Ϻ����ܱ������г�ּ��ȣ����ܷ����ķ�Ӧ�У�2NaHCO3 ![]() Na2CO3+CO2��+H2O��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����CO2+2NaOH=Na2CO3+H2O����������Ϊ�������Ϊ̼���ƣ��ɴ˷������
Na2CO3+CO2��+H2O��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����CO2+2NaOH=Na2CO3+H2O����������Ϊ�������Ϊ̼���ƣ��ɴ˷������
(1)������ɿ�֪Na2CO3��Na2S��1:2�����ʵ���֮�Ȼ�ϣ���ͨ�������������Ӧ����Na2S2O3�Ͷ�����̼����Ӧ��SԪ�صĻ��ϼ۴�-2�����ߵ�+2�ۣ�S�Ļ��ϼ۴�+4�۽��͵�+2�ۣ�����ԭ�Ӹ����غ㡢��ʧ�����غ㷴Ӧ�ķ���ʽ��2Na2S+Na2CO3+4SO2��3Na2S2O3+CO2��Na2S��Һ�ڿ����г��ڷ��ã���������Ӧ������������ƵĽṹ����ѧ�������Ƶ�����Na2S2�������ʽΪ![]() ��
��
(2)���Ի�����S2O32-�����绯��Ӧ�����ӷ���ʽ��S2O32-+2H+=S��+H2O+SO2����
(3)��ҵ���ô��մ���Һ���չ�ҵ�����е�����������������ΪSO42-�����ӷ�Ӧ����ʽΪ��S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+������Һ�еμ�ϡ�����ữ���ٵμ�BaCl2��Һ���а�ɫ�������ɣ�˵����Һ�к���SO42-����֤����Ӧ�Ѿ��������ʴ�ΪB��
(4)Na2O2��������NaHCO3��Ϻ����ܱ������г�ּ��ȣ����ܷ����ķ�Ӧ�У�2NaHCO3![]() Na2CO3+CO2��+H2O��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����CO2+2NaOH=Na2CO3+H2O����������Ϊ�������Ϊ̼���ƣ���n(NaHCO3)��n(Na2O2)��2��
Na2CO3+CO2��+H2O��2Na2O2+2CO2=2Na2CO3+O2��2Na2O2+2H2O=4NaOH+O2����CO2+2NaOH=Na2CO3+H2O����������Ϊ�������Ϊ̼���ƣ���n(NaHCO3)��n(Na2O2)��2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��������������Դ�������ֲ��ϵ�����ʾ��ͼ���¡�����˵����ȷ����(�� ��)
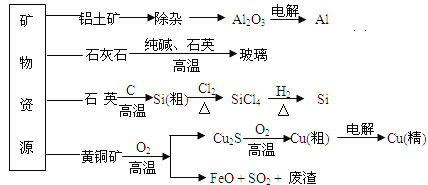
��ע���������к���A12O3��SiO2��Fe2O3��
A. ���������Ʊ��ϸߴ���A1�Ĺ�����ֻ�õ�NaOH��Һ��CO2���塢����ʯ
B. ʯ��ʯ�����ʯӢ�������������Σ����������ᷴӦ
C. ���ƴֹ�ʱ���������뻹ԭ�������ʵ���֮��Ϊ1��2
D. ��ͭ��CuFeS2)��O2��Ӧ������Cu2S��SO2���ǻ�ԭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС��ʵ����ģ�ҵ�Ʊ����軯��(KSCN)��ʵ��װ����ͼ��
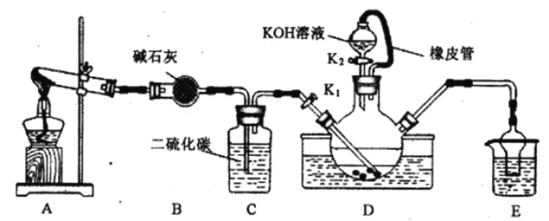
ʵ�鲽�����£�
(1)�Ʊ� NH4SCN��Һ��CS2+2NH3![]() NH4SCN+H2S���÷�Ӧ�Ƚϻ�����
NH4SCN+H2S���÷�Ӧ�Ƚϻ�����
��ʵ��ǰ��Ӧ���еIJ�����______________________��������ƿ��ʢ����CS2��ˮ�ʹ�����������ƿ���²�CS2Һ������û�����ܿڣ�Ŀ����______________________��
��ʵ�鿪ʼʱ��K1������װ��A��D����������װ��D�г������塣װ��A�е�������___________(�Ի�ѧʽ��ʾ)��װ��C�����ÿ�����______________________��
(2)�Ʊ�KSCN��Һ����ȥA���ľƾ��ƣ��ر�K1����K2�������ͼ��Һ©����Һ���ȣ����ʱװ��D�з�����Ӧ�Ļ�ѧ����ʽ��_________________________________��
(3)�Ʊ�KSCN���壺����ȥ������ƿ�еĹ���������ټ�ѹ����Ũ����___________�����ˣ�����õ����軯�ؾ��塣
(4)�ⶨKSCN�ĺ�����ȡ10.0g��Ʒ���1000mL��Һ��ȡ20.00mL����ƿ�У������뼸��Fe(NO3)3��Һ����0.1000mol/LAgNO3����Һ�ζ����ﵽ�ζ��յ�ʱ��AgNO3����Һ20.00mL��
�ٵζ�ʱ���������ӷ�ӦΪSCN��+Ag+= AgSCN�������յ�ʱ��������___________��
��KSCN����������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ�������ݣ��ݴ˻ش��й����⣺

��1����Ũ�������ʵ���Ũ��Ϊ________________��
��2��ȡ����������ĸ�Ũ����ʱ�������������в�����ȡ����Ķ��ٶ��仯����_________(����ĸ���)��
a����Һ��H2SO4�����ʵ��� b����Һ��Ũ�� c����Һ���ܶ�
��3��ijͬѧ��������Ũ���������ˮ����500mL0.400mol��L��1��ϡ���ᡣ�ṩ�������У���ͷ�ιܡ����������ձ�����Ͳ��ϸ���Լ�ƿ��
������ϡ����ʱ����ȱ�ٵ�������_______________(д����)���������ϱ���_____(����ĸ���)��
a���¶� b��Ũ�� c������ d��ѹǿ e���̶���
�ڸ�ѧ����Ҫ��ȡ_________mL����Ũ����������ơ�
�������ƹ����У�����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ�죿 (�ں�������д��ƫ��������ƫС��������Ӱ����)����Ͳ��ȡŨ����ʱ���ӹ۲찼Һ��__________________�����ݡ�ҡ�Ⱥ��ã�Һ����ڿ̶��ߣ�������ˮ���̶���________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֽ�1.92gCuͶ�뵽һ������ŨHNO3�У�Cu��ȫ�ܽ⣬����������ɫԽ��Խdz�����ռ�����״����672mL��NOX������壬��ʢ�д����������������ˮ���У�ͨ���״����һ�������O2��ǡ��ʹ������ȫ����ˮ����ͨ���״���µ�O2�����Ϊ�� ��
A. 504mLB. 336mLC. 224mLD. 168mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������м������ʣ��뽫����������пո��ڣ�
A��CH2=CH-COOH�����ᣨC17H33COOH�� B��12C60��ʯī
C��![]() ��
�� ![]() D��35Cl��37Cl E���Ҵ����Ҷ���
D��35Cl��37Cl E���Ҵ����Ҷ���
�ٻ�Ϊͬλ�ص���_____________�� �ڻ�Ϊͬϵ�����________________��
�ۻ�Ϊͬ�����������__________���ܻ�Ϊͬ���칹�����_____________��
�ݼȲ���ͬϵ��ֲ���ͬ�����壬Ҳ����ͬ�������壬���ɿ�����ͬһ�����ʵ���____��
��2��д�������л����ϵͳ������ṹ��ʽ��
A��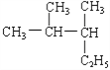 ��________________________��
��________________________��
B��CH3CH(CH3)C(CH3)2(CH2)2CH3��_______________________��
C��3��4-����-4-�һ����飺______________________________��
D��2������2����ϩ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����գ�ѩ�����裬��װ�ع��������Ǵ����������ܣ�����ѩȴ�����·ͨ�д����鷳������һ�ָ��ٹ�·����ɫ��ѩ������CMA(����ơ�����þ��������)��������������ʯ(��Ҫ�ɷ�MgCO3��CaCO3����SiO2������)�������ʷ�Һ����ľ��Һ(��Ҫ�ɷ����ᣬ�Լ������ļ״������ӡ����͵�����)��Ϊԭ�ϣ�������ͼ��
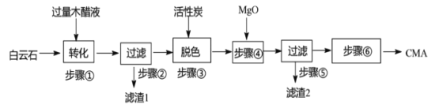
��1������ٷ����ķ�Ӧ���ӷ���ʽΪ____��
��2������1����Ҫ�ɷ���NaOH��Һ��Ӧ���Ȼ�ѧ����ʽΪ___(��֪��l mol NaOH������Ӧʱ�ų�����ΪQkJ)�������������Һ���ʺ�ɫ��������֪��ԭ����Ҫ��ľ��Һ�к�����������ɫ�Ľ����Լ�____��
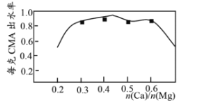
��3����֪CMA�иơ�þ�����ʵ���֮�����ˮ��(����ѩЧ��������)��ϵ��ͼ��ʾ������ܵ�Ŀ�ij�����n(Ca)��n(Mg)ԼΪ__(ѡ�A.1��3��B.1��2��C.3��7��D.2��3)�⣬��һĿ����___��
��4������ް����IJ�����___�����ˡ�ϴ�Ӽ����
��5��ȡakg��MgCO3��CaCO3��������Ϊb%�İ���ʯ���������������Ʊ�CMA����֪MgCO3��CaCO3����ʧ��Ϊc%�������֮��ƷCMA����ʧ��Ϊd%������ϣ�3����֪���ò�Ʒ����ԼΪ____kg(���ú������ĸ�ļ���ʽ������ػ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
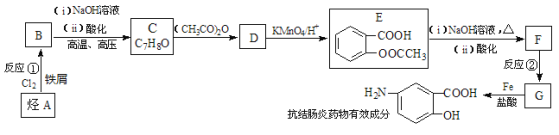
����Ŀ������ѧ��ѡ��5 �л���ѧ������ij���᳦��ҩ����Ч�ɷֵĺϳ�·������(���ַ�Ӧ��ȥ�Լ�������)��
��֪��
��ش��������⣺
��1�����᳦��ҩ����Ч�ɷֵķ���ʽ�ǣ�_____________����A������Ϊ��_____________����Ӧ�ڵķ�Ӧ�����ǣ�___________________��
��2�������жԸÿ��᳦��ҩ����Ч�ɷֿ��ܾ��е������Ʋ���ȷ���ǣ�____________��
A��ˮ���Աȱ��Ӻ� B���ܷ�����ȥ��ӦҲ�ܷ����ۺϷ�Ӧ
C��1mol������������4mol H2������Ӧ D�������������м���
�� E������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ�ǣ�_______________________��
��3���������������Ŀ��᳦��ҩ����Ч�ɷֵ�ͬ���칹����________�֡�
A����FeCl3��Һ����ɫ��Ӧ B�������м��뱽��ֱ������ C�������Ϲ�������ȡ����
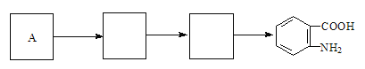
��4����֪���������������ʱ������һ��ȡ��������ȡ����������ڶ�λ�����������������Ȼ�ʱ��ȡ���ڼ�λ,�ݴ˰��Ⱥ�˳��д����AΪԭ�Ϻϳ��ڰ���������(![]() )�ϳ�·���������м����Ľṹ��ʽ(���ַ�Ӧ��������ȥ)
)�ϳ�·���������м����Ľṹ��ʽ(���ַ�Ӧ��������ȥ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У��������뻹ԭ�����ʵ���֮��Ϊ1��2����(����)
A. 3S��6NaOH===2Na2S��Na2SO3��3H2O
B. 2CH3COOH��Ca(ClO)2===2HClO��Ca(CH3COO)2
C. 4HCl(Ũ)��MnO2![]() MnCl2��Cl2����2H2O
MnCl2��Cl2����2H2O
D. I2��2NaClO3===2NaIO3��Cl2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com