
| A�� | ��������������ͨ�����������Һ�У�SO2+H2O+3ClO-�TSO42-+Cl-+2HClO | |
| B�� | �ð�ˮ�ܽ��Ȼ���������Ag++2 NH3•H2O�T[Ag��NH3��2]++2H2O | |
| C�� | �ö��Ե缫���MgCl2��Һ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+2OH- | |
| D�� | �����ʵ�����Ba��OH��2�루NH4��2Fe��SO4��2����Һ�з�Ӧ��Ba2++2OH-+2NH4++SO42-�TBaSO4��+2NH3•H2O |
���� A������������ԭ��Ӧ���������ƣ�
B���ð�ˮ�ܽ��Ȼ�������������������Һ��
C����Ӧ����������þ��������������
D�������ʵ�����Ӧ���������ᱵ��������������һˮ�ϰ���
��� �⣺A��������������ͨ�����������Һ�е����ӷ�ӦΪSO2+3ClO-+H2O=SO42-+2HClO+Cl-����A����
B���ð�ˮ�ܽ��Ȼ������������ӷ�ӦΪAg++2 NH3•H2O�T[Ag��NH3��2]++2H2O����B��ȷ��
C���ö��Ե缫���MgCl2��Һ�����ӷ�ӦΪMg2++2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+Mg��OH��2������C����
D�������ʵ�����Ba��OH��2�루NH4��2Fe��SO4��2����Һ�з�Ӧ�����ӷ�ӦΪ2Ba2++4OH-+2NH4++Fe2++2SO42-�T2BaSO4��+2NH3•H2O+Fe��OH��2������D����
��ѡB��
���� ���⿼�����ӷ�Ӧ����ʽ��д�������жϣ�Ϊ��Ƶ���㣬���շ����ķ�Ӧ�����ӷ�Ӧ����д����Ϊ���Ĺؼ�������������ԭ��Ӧ�����ֽⷴӦ�����ӷ�Ӧ���飬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �Ҷ����������ᣬ�����ǻ�ѧѧϰС���ͬѧ�Բ��ᾧ�壨H2C2O4•xH2O�����е�̽����ѧϰ
�Ҷ����������ᣬ�����ǻ�ѧѧϰС���ͬѧ�Բ��ᾧ�壨H2C2O4•xH2O�����е�̽����ѧϰ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | c��A-��+c��HA��=0.02 mol•L-1 | B�� | ����Һ��pH��7 | ||
| C�� | HA�����Ժ�����A-ˮ��̶Ƚϴ� | D�� | n��A-��+n��OH-��-n��H+��=0.01 mo1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ������Ԫ��X��Y��Z��������Ϊ1��7��12�γɵĻ����������������ӵ����ӷ�Ӧ����ʽ�ǣ�
������Ԫ��X��Y��Z��������Ϊ1��7��12�γɵĻ����������������ӵ����ӷ�Ӧ����ʽ�ǣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.0 L 1.0 mo1•L-1��NaAlO2 ˮ��Һ�к��е���ԭ����Ϊ2 NA | |
| B�� | �ܱ�������2 mol NO��1 mol O2��ַ�Ӧ������ķ�����Ϊ2 NA | |
| C�� | ����������ˮ��Ӧʱ������0.1 mol ����ת�Ƶĵ�����Ϊ0.2 NA | |
| D�� | ��״���£�33.6 L�������к��з�ԭ�ӵ���ĿΪ1.5 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X�Ļ�ѧʽΪ��K2O2 | B�� | KNO3����������Ӧ | ||
| C�� | NaN3�ĵ���ʽΪ | D�� | ���������뻹ԭ����������Ϊ1��15 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
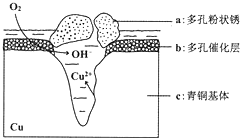 ��ͼ��ʾΪ��ͭ���ڳ�ʪ�����з����ĵ绯ѧ��ʴ��ʾ��ͼ������˵��������ǣ�������
��ͼ��ʾΪ��ͭ���ڳ�ʪ�����з����ĵ绯ѧ��ʴ��ʾ��ͼ������˵��������ǣ�������| A�� | ��ʴ�����У�ͭ������ | |
| B�� | ��֪�����е� Cl-��ɢ���ڣ�����������Ӧ���������Ӧ�����������ɶ��ͭ��Cu2��OH��3Cl���������ӷ���ʽΪ��2Cu2++3OH-+Cl-=Cu2��OH��3Cl�� | |
| C�� | ������ 4.29 g Cu2��OH��3Cl���������Ϻ��������Ϊ 0.448 L | |
| D�� | �����ĵ缫��ӦʽΪ��O2+4e-+2H2O=4OH- |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com