
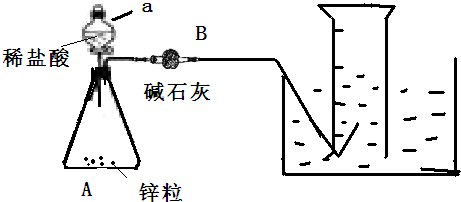
分析 (1)A仪器中利用盐酸与锌发生置换反应生成氢气和氯化锌;
(2)根据压强差的原理可以检查该装置气密性;
(3)根据装置图可知A装置中仪器a的名称;
(4)B仪器中装有碱石灰,可以吸收氢气中的氯化氢气体;
(5)根据上述数据可知,氢气的体积为b mL,氢气的质是为ag-cg,所以氢气物质的量为$\frac{a-c}{2}$mol,据此计算H2的摩尔体积.
解答 解:(1)A仪器中利用盐酸与锌发生置换反应生成氢气和氯化锌,反应的方程式为Zn+2HCl═ZnCl2+H2↑,
故答案为:Zn+2HCl═ZnCl2+H2↑;
(2)根据压强差的原理可以检查该装置气密性,具体操作为关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好,
故答案为:关闭分液漏斗的活塞,把导管插入水中,微热锥形瓶,若导管口有气泡冒出,停止微热后,导管内形成一段液柱,且在一段时间内液柱高度不变,则说明气密性良好;
(3)根据装置图可知A装置中仪器a的名称为分液漏斗,
故答案为:分液漏斗;
(4)B仪器中装有碱石灰,可以吸收氢气中的氯化氢气体,所以若拆除B仪器,H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致c偏小,对实验产生影响,
故答案为:会;H2中混有的HCl气体和水蒸气的质量会被当成是H2的质量而导致c偏小,对实验产生影响;
(5)根据上述数据可知,氢气的体积为b mL,氢气的质是为ag-cg,所以氢气物质的量为$\frac{a-c}{2}$mol,H2的摩尔体积Vm=$\frac{b×1{0}^{-3}L}{\frac{a-c}{2}mol}$=$\frac{2b×1{0}^{-3}}{a-c}$L/mol,
故答案为:$\frac{2b×1{0}^{-3}}{a-c}$L/mol.
点评 本题以氢气的摩尔体积测定为载体,考查实验基本技能与操作、对实验装置的理解分析、化学计算等,本题测重基本实验操作能力和计算的考查,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NF3气体密度比空气小 | B. | 过程N(g)+3F(g)→NF3(g)放出热量 | ||
| C. | NF3属于易燃、高能物质 | D. | NF3室温条件下不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+3ClO-═SO42-+Cl-+2HClO | |
| B. | 用氨水溶解氯化银沉淀:Ag++2 NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| D. | 等物质的量的Ba(OH)2与(NH4)2Fe(SO4)2在溶液中反应:Ba2++2OH-+2NH4++SO42-═BaSO4↓+2NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
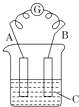 如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.
如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
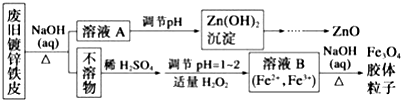
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com