黄铜矿(CuFeS
2)是制取铜的主要原料,还可制备硫及铁的化合物.
(1)冶炼铜的反应为:
8CuFeS
2+21O
28Cu+4FeO+2Fe
2O
3+16SO
2若CuFeS
2中Cu、Fe的化合价均为+2,反应中被氧化的元素有
(填元素符号).
(2)上述冶炼过程中产生大量的SO
2,下列关于SO
2的说法中正确的是
(填字母).
a.可处理后用于消毒杀菌
b.可排放到空气中消灭害虫
c.可处理后用于漂白织物
d.可用KMnO
4溶液吸收制浓硫酸
(3)过二硫酸钾(K
2S
2O
8)具有强氧化性,经少量K
2S
2O
8处理过的KI溶液遇淀粉变蓝色,写出K
2S
2O与KI溶液反应的离子方程式:
.
(4)用冶炼铜反应的固体产物配制FeCl
2溶液,首先用
处理,然后过滤,再向溶液中加入过量的
.FeCl
2溶液长期放置会变质,溶液变成棕黄色.检验FeCl
2溶液已变质加入
,溶液中立即出现
现象.
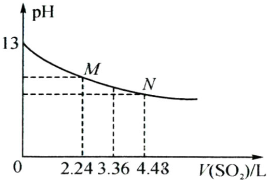
(5)将足量的SO
2慢慢通入一定体积某浓度的NaOH溶液中,溶液的pH随SO
2体积(已换算成标准状况,不考虑溶液体积变化)的变化曲线如图所示:
①NaOH溶液的物质的量浓度为
mol?L
-1;
②n(SO
2):n(NaOH)=1:2,反应对应M点的纵坐标
7(填“<”、“=”或“>”);
③N点溶液中含有的阴离子除OH
-外,还有
(填化学式).





