
(12分)
(1)室温下,在pH=12的NaCN溶液中,由水电离的c(OH—)为 mol·L-1 。(2)等体积的下列溶液中,阳离子的总物质的量最大的是 。(填序号)。
① 0.2 mol·L-1的CuSO4溶液 ② 0.1 mol·L-1的Na2CO3
③ 0.2 mol·L-1的KCl ④ 0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺 。(填序号)。
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
(4) 水的电离平衡如图所示:
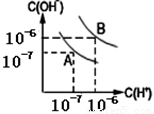
①若A点表示25℃时水的电离平衡状态,当温度上升到100℃时,水的电离平衡状态到达B点。则此时水的离子积从 增加到 。
②100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH值pH1与强碱的pH值pH2之间应满足的关系是 。
(1)10-2 (2)①
(3)② >① > ④ > ③ (4)① 10—14 10—12
② pH1+pH2=13
【解析】(1)NaCN水解显碱性,促进水的电离,所以,由水电离的c(OH—)为0.01 mol·L-1 。
(2)①③的浓度大,阳离子的数量就多。因为1个铜离子水解生成2个阳离子,方程式为Cu2++2H2O Cu(OH)2+2H+。即①中阳离子的总物质的量最大。
Cu(OH)2+2H+。即①中阳离子的总物质的量最大。
(3) NH4+水解显酸性,NH4HSO4能电离出氢离子抑制其水解,而CH3COONH4中醋酸根水解显碱性,促进NH4+水解,所以c(NH4+)由大到小的顺序为② >① > ④ > ③。
(4)温度升高促进水的电离,由图像可知当温度升高到100℃时,水的离子积将由10—14升高到10—12。溶液显中性,则10×10-pH1=1×10 pH2-12,解得pH1+pH2=13。


科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 |
室温下单质呈粉末状固体,加热易熔化. 单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
单质常温、常压下是气体,能溶于水. 原子的M层有1个未成对的p电子. |
单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. |
原子最外层电子层上s电子数等于p电子数. 单质为空间网状晶体,具有很高的熔、沸点. |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 |
室温下单质是粉末状固体,加热易熔化. 单质在空气中燃烧生成的气体是形成酸雨的主要污染物之一. |
单质常温、常压下是黄绿色气体,能溶于水. | 单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. |
原子最外层电子层上s电子数等于p电子数. 单质是一种常见的半导体材料. |
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 室温下单质呈粉末状固体,加热易熔化。单质在空气中燃烧,发出明亮的蓝紫色火焰。 | 单质常温、常压下是气体,能溶于水。原子的M层有1个未成对的p电子。 | 单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 | 原子最外电子层上s电子数等于p电子数,等于电子层数。
|
(1)B元素在周期表中的位置 是___ 区 ,写出A离子的电子排布式___
(2)写出C单质与水反应的离子方程式 ________
(3)A、B、C、 D四种元素的第一电离能由大到小的顺序 ________
(4)A、B两元素非金属性较强的是(写元素符号) ________ 。写出证明这一结论的一个
实验事实 ________
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省双流中学高二上学期期中考试化学试卷 题型:填空题
(8分)四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 室温下单质呈粉末状固体,加热易熔化。单质在空气中燃烧,发出明亮的蓝紫色火焰。 | 单质常温、常压下是气体,能溶于水。原子的M层有1个未成对的p电子。 | 单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰 。 。 | 原子最外电子层上s电子数等于p电子数,等于电子层数。 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com