
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
分析 (1)氢氧化钠与醋酸生成醋酸钠和水,醋酸是弱酸,书写离子方程式时不能拆开;
(2)滴定时操作步骤为:滴定管查漏→水洗→润洗→注液、调节液面→排气泡、记录刻度→注入待测液→滴定至终点读数.
(3)醋酸与氢氧化钠溶液完全中和后生成醋酸钠溶液,呈碱性,所以应选择在碱性范围内变色的指示剂(酚酞),终点的现象是当滴加最后一滴氢氧化钠溶液时,溶液变为浅红色且30s不褪色.
(4)先分析数据的有效性,然后求出平均值,然后根据C(NaOH)V(NaOH)=C(CH3COOH)V(CH3COOH)得醋酸物质的量浓度;
(5)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差.
解答 解:(1)氢氧化钠与醋酸生成醋酸钠和水,用离子方程式表示该实验的原理为:CH3COOH+OH-=CH3COO-+H2O,
故答案为:CH3COOH+OH-=CH3COO-+H2O;
(2)滴定时操作步骤为:滴定管查漏→水洗→润洗→注液、调节液面→排气泡、记录刻度→注入待测液→滴定至终点读数,
故答案为:G→D→A→F→B→H→C;
(3)醋酸与氢氧化钠溶液完全中和后生成醋酸钠溶液,醋酸钠为强碱弱酸盐,水溶液中水解生成醋酸与氢氧化钠,化学方程式:CH3COONa+H2O?CH3COOH+NaOH,呈碱性,所以应选择在碱性范围内变色的指示剂(酚酞),终点的现象是当滴加最后一滴氢氧化钠溶液时,溶液变为浅红色且半分钟内不褪色,
故答案为:酚酞;两者恰好完全中和生成醋酸钠,其水溶液呈碱性,必需选择在碱性范围变色且颜色容易判断的酚酞作指示剂判断滴定终点;无色溶液变浅红色且半分钟内不褪色;
(4)五次实验消耗氢氧化钠溶液体积分别为15.75mL、15.00mL、14.98mL、15.02mL、15.00mL,其中15.75mL误差太大,应舍弃,所以氢氧化钠溶液体积平均为15.00mL,氢氧化钠溶液浓度为0.1mol/L,醋酸体积为20.00mL,由C(NaOH)V(NaOH)=C(CH3COOH)V(CH3COOH)得醋酸物质的量浓度为0.07500mol/L,
故答案为:0.07500;
(5)①滴定前碱式滴定管充满溶液,滴定后尖嘴处有气泡,则氢氧化钠溶液体积偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知醋酸浓度偏小,
故答案为:偏低;
②读取标准溶液体积时,滴定前平视、滴定后仰视,则氢氧化钠溶液体积偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$可知醋酸浓度偏高,
故答案为:偏高.
点评 本题主要考查了酸碱中和滴定的操作步骤、化学计算、指示剂选择,在分析误差时,关键是分析滴定管中氢氧化钠溶液的体积,若氢氧化钠溶液体积偏大,则所测醋酸浓度偏大,题目难度中等.


科目:高中化学 来源: 题型:解答题

| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | - | - | - |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
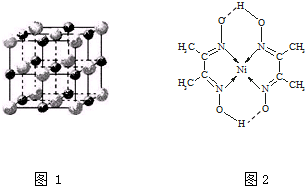 (1)已知A和B为第三周期元素,其原子的第一至第四电离能如表1所示:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如表1所示:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com