
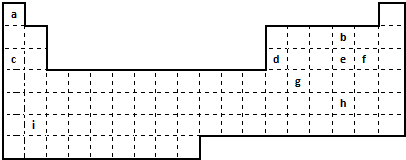
| A. | 核电荷数 | B. | 最外层电子数 | ||
| C. | 核内质子数和中子数 | D. | 相对原子质量的大小 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 | 5 |
| V(NaOH)/mL(初读数) | 0.00 | 0.20 | 0.00 | 0.10 | 0.05 |
| V(NaOH)/mL(终读数) | 15.75 | 15.20 | 14.98 | 15.12 | 15.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
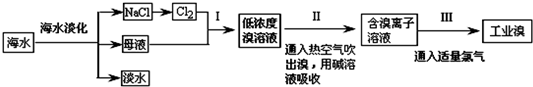
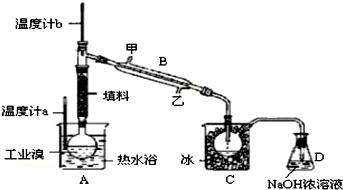
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
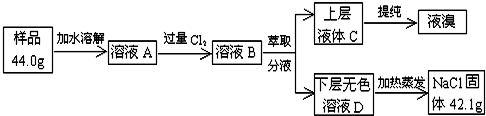
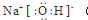 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是一种特殊化学键,它广泛地存在于自然界中 | |
| B. | 在 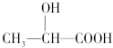 分子中含有1个手性C原子 分子中含有1个手性C原子 | |
| C. | 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子 | |
| D. | 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com