
����Ŀ����֪X��Y��Z����Ԫ�ؾ�Ϊ������Ԫ�أ�ԭ���������ε�����Q��WΪǰ30��Ԫ�ء�5��Ԫ�صIJ����ص㣺

��1��XF3������X���ӻ�����Ϊ______���÷��ӵĿռ乹��Ϊ_______��
��2����̬Qԭ�ӵĵ����Ų�ʽΪ_____________________����һ�����ܣ�X______Y������� ��������=���� ��
��3��X��Y��Z�縺���ɴ�С��˳��Ϊ____________����Ԫ�ط��ű�ʾ����
��4��Na��Y2��ȼ�ղ���ĵ���ʽΪ________________��
��5��Z��X�γɵĻ����ﳣ���������ͻ���ϣ���ѧ�����ȶ����ݴ��Ʋ���Ӧ����_______���壮
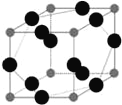
��6��WԪ����XԪ���γ�ij�ֻ�����ľ����ṹ��ͼ��ʾ���������Wԭ�ӣ������þ�����ܶ�Ϊ�� g��cm-3����þ����������__________cm3��
���𰸡� sp3 ������ 1s22s22p63s23p63d24s2 �� O��N��Si ![]() ԭ�� 206/(NA.��)
ԭ�� 206/(NA.��)
�����������⿼��λ�ýṹ���ʵ����ϵ����1��X����̬�⻯��������Σ�ˮ��Һ�Լ��ԣ�XΪN��NF3�����м۲���ӶԸ���=��������+�µ��ӶԸ���=3+![]() =4������NF3������N���ӻ�����Ϊsp3���÷��ӵĿռ乹��Ϊ�����Σ���2��Q����Ϊ��̫�ս�������Ҳ�������������֮�ƣ�QΪ22��Ԫ����(Ti)����̬ԭ�ӵĵ����Ų�ʽΪ��1s22s22p63s23p63d24s2��Y���������������ڴ�����������3�����һ�̬ԭ�Ӻ�����3���ܼ�����YΪO��Ԫ��N��O����ͬһ����Ԫ����ԭ��������������ͬһ����Ԫ�صĵ�һ����������ԭ������������������ڢ�A��Ĵ��ڵڢ�A��ģ��������һ�����ܴ�С˳����X(N)��Y(O)����3��ZԪ��ԭ�ӵ���Χ����Ϊnsn-1npn-1��s�ܼ��������2�����ӣ�����n=3����Z��SiԪ�أ��ǽ�����Խǿ�縺��Խ���֪X(N)��Y(O)��Z(Si)�ĵ縺���ɴ�С��˳��Ϊ��O��N��Si�� ��4��Na��Y2(O2)��ȼ�ղ���λNa2O2�������ʽΪ
=4������NF3������N���ӻ�����Ϊsp3���÷��ӵĿռ乹��Ϊ�����Σ���2��Q����Ϊ��̫�ս�������Ҳ�������������֮�ƣ�QΪ22��Ԫ����(Ti)����̬ԭ�ӵĵ����Ų�ʽΪ��1s22s22p63s23p63d24s2��Y���������������ڴ�����������3�����һ�̬ԭ�Ӻ�����3���ܼ�����YΪO��Ԫ��N��O����ͬһ����Ԫ����ԭ��������������ͬһ����Ԫ�صĵ�һ����������ԭ������������������ڢ�A��Ĵ��ڵڢ�A��ģ��������һ�����ܴ�С˳����X(N)��Y(O)����3��ZԪ��ԭ�ӵ���Χ����Ϊnsn-1npn-1��s�ܼ��������2�����ӣ�����n=3����Z��SiԪ�أ��ǽ�����Խǿ�縺��Խ���֪X(N)��Y(O)��Z(Si)�ĵ縺���ɴ�С��˳��Ϊ��O��N��Si�� ��4��Na��Y2(O2)��ȼ�ղ���λNa2O2�������ʽΪ![]() ����5����͵��γɵĻ����ﵪ���裬�����۵�ߣ���ѧ�����ȶ������Ե�����Ϊԭ�Ӿ��壻��6��WΪCu��XΪN���þ����У�Cuԭ�Ӹ���Ϊ12��
����5����͵��γɵĻ����ﵪ���裬�����۵�ߣ���ѧ�����ȶ������Ե�����Ϊԭ�Ӿ��壻��6��WΪCu��XΪN���þ����У�Cuԭ�Ӹ���Ϊ12��![]() =3��Nԭ�Ӹ���Ϊ8��
=3��Nԭ�Ӹ���Ϊ8��![]() =1���þ����Ļ�ѧʽΪCu3N���þ��������Ϊ
=1���þ����Ļ�ѧʽΪCu3N���þ��������Ϊ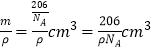 ��
��


 ϰ�⾫ѡϵ�д�
ϰ�⾫ѡϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ʊ�������������ɫ�ϳ�·��֮һΪ��

����˵������ȷ����
A. M�ķ���ʽΪC6H12O6 B. N�Ľṹ��ʽΪCH3COOH
C. �ܵķ�Ӧ��������ȡ����Ӧ D. ��������ά�ػ�Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵��ǣ��� ����
A. ��ˮ�е�������������Һ����Һ��ɫ��dz B. ��ѹ�ȳ�ѹ�����ڹ�ҵ�ϳɰ���Ӧ
C. ����ɫNO2��ѹ����ɫ��ԭ��Ҫ�� D. �ȵĴ��������Ч����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����CO2��H2��CO��ɵĻ��������ͬ��ͬѹ���뵪�����ܶ���ͬ����û��������CO2��H2��CO�������Ϊ
A. 29��8��13 B. 22��1��14 C. 13��8��29 D. 44��2��28
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ�Ļ�ѧ�������
��1��д��N2�Ľṹʽ��____��
��2��д��1��2-��������Ľṹ��ʽ��____��
��3��д��ͭ���Ȼ�����Һ��Ӧ�����ӷ���ʽ: ____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ӿ���ռ�ṹʾ��ͼ����Ϊ�����ӣ���Ϊ����������M���������ӣ�N���������ӣ���ѧʽΪMN2�ľ���ṹΪ�� ��
A�� B��
B�� C��
C�� D��
D��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȤС��ͨ��ʵ�鷢�ּغ��Ƶ��������ƣ�����˵��������õؽ��������ʵ����( )
A. ���ǽ���Ԫ�� B. ԭ�Ӱ뾶����
C. ������������ͬ D. ����ϼ���ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com