
【题目】现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体.相应的实验过程如图: 
(1)操作①是利用胶体不能通过而把淀粉胶体和溶液进行分离.
(2)写出上述实验过程中所用试剂的化学式:试剂①;试剂③ .
(3)判断试剂①已过量的操作是: .
(4)控制试剂③适量的方法是: .
(5)试剂②的作用(用化学方程式表示): .
【答案】
(1)半透膜
(2)BaCl2;HCl
(3)静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量
(4)当溶液中不产生气泡时,就可以停止加盐酸
(5)Ba2++CO32﹣=BaCO3↓
【解析】解:(1)淀粉为胶体,粒子直径较大,不能透过半透膜,所以可以把淀粉胶体和溶液进行分离,故答案为:半透膜;(2)由以上分析可知试剂①为BaCl2 , 试剂③为HCl,故答案为:BaCl2;HCl;(3)判断试剂①已过量的方法是静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量,
故答案为:静置,向上层清液中滴加少量氯化钡溶液,无白色沉淀产生,说明氯化钡溶液已过量;(4)试剂③为盐酸,加入盐酸可除去过量的Na2CO3 , 同时产生气泡,所以控制试剂③适量的方法是观察溶液中是否有气泡出现,当溶液中不产生气泡时,就可以停止加盐酸,故答案为:当溶液中不产生气泡时,就可以停止加盐酸;(5)试剂②为Na2CO3 , 是用来除去溶液中的钡离子的,反应的离子方程式为Ba2++CO32﹣=BaCO3↓,
故答案为:Ba2++CO32﹣=BaCO3↓.
胶体不能透过半透膜,操作①为渗析,除去Na2SO4、CaCl2 , 可分别加入BaCl2、Na2CO3 , 除去粗盐中含有的Ca2+、SO42﹣可溶性杂质的方法:加入过量BaCl2 , 去除硫酸根离子;再加入过量Na2CO3(去除钙离子),则试剂①为BaCl2 , 操作②为过滤,沉淀A为硫酸钡,试剂②为Na2CO3 , 操作③为过滤,沉淀B为碳酸钙和碳酸钡,试剂③为盐酸,加入盐酸可除去过量的Na2CO3 , 最后蒸发结晶可得到NaCl晶体,以此解答该题.


科目:高中化学 来源: 题型:
【题目】某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。
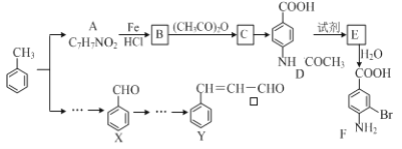
已知:①![]()
![]()
![]()
②![]()
③CH3COOH+CH3COOH→(CH3CO)2O+H2O
请回答下列问题:
(1)下列有关F的说法正确的是______________。
A.分子式是C7H7NO2Br B.F即能与HCl又能与NaOH应生成盐
C.能发生取代反应和缩聚反应 D.1 mol的 F最多可以和2 mol NaOH反应
(2)C→ D的反应类型是 _____。
(3)在合成F的过程中,B→C步骤不能省略,理由是_____________________。
(4)D→E反应所需的试剂是 ___________________。
(5)写出同时符合下列条件的A的同分异构体的结构简式(写出其中1个)_________________。
①苯环上只有两种不同化学环境的氢原子②分子中含有-CHO
(6)利用已知信息,以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。___________ 注:合成路线的书写格式参照如下示例流程图:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商店买回的硫酸试剂的标签部分内容。据此判断,下列说法正确的是( )

A. 1 mol Al 与足量的该硫酸产生2 g氢气
B. 配制 240 mL 4.6 mol/L 的稀硫酸需取该硫酸 40 mL
C. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
D. 该硫酸与等质量的水混合后所得溶液的物质的量浓度小于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中进行反应:X2(g)+Y2(g)![]() Z(g)。已知X2、Y2、Z的起始浓度分别为 0.1 mol L-1、0.3mol L-1、0.2mol L-1。在一定条件下,当反应达到平衡时,各物质的量浓度可能是
Z(g)。已知X2、Y2、Z的起始浓度分别为 0.1 mol L-1、0.3mol L-1、0.2mol L-1。在一定条件下,当反应达到平衡时,各物质的量浓度可能是
A. Z为0.3mol L-1 B. Y2为0.4 mol·L-1
C. X2为0.3mol L-1 D. Z为0.4mol L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙.
【查阅资料】
Ⅰ.金属Ca的部分性质有:
①常温或加热条件下Ca都能与氧气反应;
②Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③Ca+H2 ![]() CaH2(固体)
CaH2(固体)
Ⅱ.固体CaH2的部分性质有:
①常温:CaH2+2H2O=Ca(OH)2+2H2↑; ②CaH2要密封保存.
(1)【进行实验】
该小组同学设计的制取装置如图所示(固定装置略).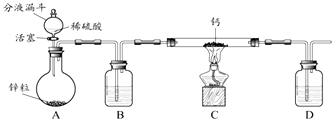
回答下列问题:
(i)写出Ca常温遇水发生反应的化学方程式: .
(ii)B、D中所盛试剂相同,该试剂为(填名称);D中该试剂的作用是 .
(iii)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是: .
(2)【实验反思】
该小组同学通过反思提出问题:上述制得的CaH2是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量为m g的CaH2样品,按图所示连接仪器(固定装置略).
步骤2:将Y形管倾斜,使A中的水全部进入B中,样品全部反应后,冷却至室温,读取量筒读数为V mL.
(iv)若该实验条件下的气体摩尔体积为Vm L/mol,当V=mL时(用m、Vm表示),表明制得的CaH2样品是纯净的.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏伽德罗常数(NA)的说法错误的是( )
A.32g O2所含的原子数目为NA
B.0.5mol H2O含有的原子数目为1.5NA
C.1mol H2O含有的H2O分子数目为NA
D.0.5NA个氧气分子的物质的量是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年8月7日,PLOS Biology在线发表了关于玉米生物固氮的研究,为减少化肥使用和发展绿色农业提供重要的理论指导,固氮通常指将氮元素从游离态转化为化合态的过程。下列变化属于固氮的是
A.NH3→NOB.N2 → NH3
C.NO →NO2D.NO2→HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》记载了民间酿酒的工艺“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次……价值数倍也”。以上用到的实验方法可应用于分离
A. 氯化钠和淀粉的混合溶液B. 汽油和煤油
C. 苯和氢氧化钠溶液D. 硝酸钾和氯化钠的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com