
����Ŀ��CH4��������CO2�����ɵõ�����CO�Ļ���ԭ�ϡ��ش��������⣺
��1��CH4��������CO2�Ĵ�ת����ͼ��ʾ��

����֪��ط�Ӧ�������仯��ͼ��ʾ��

���̢���Ȼ�ѧ����ʽΪ________��
�ڹ����������̢��˵������ȷ����________������ţ���
a��ʵ���˺�̼�����뺬�����ʵķ���
b���ɱ�ʾΪCO2��H2��H2O��g����CO
c��COδ���뷴Ӧ
d��Fe3O4��CaOΪ�����������˷�Ӧ�Ħ�H
�������������䣬�ڲ�ͬ�������������£���ӦCH4��g����CO2��g����2CO��g����2H2��g��������ͬʱ���CH4��ת�����淴Ӧ�¶ȵı仯��ͼ��ʾ��a����������״̬________����ǡ����ǡ���ƽ��״̬��b��CH4��ת���ʸ���c�㣬ԭ����________��
��2����һ�����ܱ������У�CH4��CO2�ķ�ѹ�ֱ�Ϊ20kPa��25kPa������Ni������Al2O3������������1123Kʹ�䷢����ӦCH4��g����CO2��g����2CO��g����2H2��g����

���о�����CO���������ʦԣ�CO����1.3��10��2��p��CH4����p��CO2��mol��g��1��s��1��ijʱ�̲��p��CO����20kPa����p��CO2����________kPa���ԣ�CO����________mol��g��1��s��1��
�ڴﵽƽ�������ϵѹǿ����ʼʱ��1.8������÷�Ӧ��ƽ�ⳣ���ļ���ʽΪKp��________��kPa��2�����ø����ʵķ�ѹ�������ʵ���Ũ�ȼ��㣩
��3��CH4��������CO2�õ���CO��ż����Ӧ���Ƶò��ᣨH2C2O4���������£���ijŨ�ȵIJ�����Һ�м���һ��Ũ�ȵ�NaOH��Һ��������Һ��![]() �����ʱ��Һ��pH��________������֪������H2C2O4��Ka1��6��10��2��Ka2��6��10��5��lg6��0.8��
�����ʱ��Һ��pH��________������֪������H2C2O4��Ka1��6��10��2��Ka2��6��10��5��lg6��0.8��
���𰸡�CH4(g)+CO2(g)=2CO(g)+2H2(g) ��H=247.4kJ��mol-1 cd ���� b��c��δ��ƽ�⣬b���¶ȸߣ���Ӧ���ʿ죬��ͬʱ����ת���ʸ� 15 1.95 ![]() 2.7
2.7
��������
����������Ӧ�������ߵ��Ȼ�ѧ����ʽ��Ӧ�ø�˹���ɿɵù���I���Ȼ�ѧ����ʽ������II�н���ѭ���������������Ӧ���ѭ��������������������ɵ��ܷ�Ӧ����ʽ�����º���ʱ�������ķ�ѹ�������ʵ��������ȣ����÷�ѹ�������ʵ������м��㡣������Һ��NaOH��Һ��Ϻ�����������ƽ����Ȼ���ڣ��ݵ��볣������ʽ�����ض���������Һ��pH��
(1)����CH4��������CO2�Ĵ�ת��ͼ������I�Ļ�ѧ��ӦΪCH4(g)+CO2(g)=2CO(g)+2H2(g)������������Ӧ�������ߵ��Ȼ�ѧ����ʽ��
CH4(g)+H2O(g)=CO(g)+3H2(g) ��H��+206.2kJ��mol-1 ��i��
CO2(g)+4H2(g)=CH4(g)+2H2O(g) ��H����165kJ��mol-1 ��ii��
(i)��2+(ii)�ù���I���Ȼ�ѧ����ʽ��CH4(g)+CO2(g)=2CO(g)+2H2(g) ��H=247.4kJ��mol-1
�����������ʱ仯Ϊ�����ϣ�CO��H2��CO2��+ ���£��������壩�� ���£�H2O��+ ���ϣ�CO���������壩���ܷ�ӦΪH2+CO2=H2O+CO��Fe3O4��CaOΪ�ܷ�Ӧ�Ĵ������ܽ��ͷ�Ӧ�Ļ�ܣ������ܸı䷴Ӧ����H����ab��ȷ��cd����
��ͨ���������ܼӿ췴Ӧ���ʣ����̷�Ӧ����ƽ���ʱ�䡣����������ʹƽ�ⷢ���ƶ��������ܸı�ƽ��ת���ʡ���ͼ��a��Ϊ��ѧƽ�⣬���¶Ȳ��䣨800������������II����I��III��CH4ת����Ӧ���䣬��a�㲻�ǻ�ѧƽ�⡣
ͬ����ͼ��b��c���㶼δ�ﵽ��ѧƽ�⡣�����⣬b��c����ֻ���¶Ȳ�ͬ��b���¶Ƚϸߣ���Ӧ���ʿ죬��ͬʱ����CH4ת���ʸߡ�
(2)�پ���̬����PV��nRT�����º���ʱij�������ķ�ѹ�������ʵ��������ȡ���Ӧ�з�ѹΪ
1123K����ʱ��CH4��g����CO2��g����2CO��g����2H2��g��
��ʼ��ѹ/kPa�� 20 25 0 0
�ı��ѹ/kPa�� 10 10 20 20
ijʱ��ѹ/kPa�� 10 15 20 20
��ijʱ��p(CO2)��15kPa��p(CH4)��10kPa��������(CO)��1.3��10��2��p(CH4)��p(CO2)mol��g��1��s��1��1.95mol��g��1��s��1��
����ﵽƽ��ʱCH4�ĸı��ѹΪx kPa��
1123K����ʱ��CH4��g����CO2��g����2CO��g����2H2��g��
��ʼ��ѹ/kPa�� 20 25 0 0
�ı��ѹ/kPa�� x x 2x 2x
ƽ���ѹ/kPa�� 20��x 25��x 2x 2x
�����⣬��![]() ��1.8�����x��18��CH4(g)��CO2(g)��CO(g)��H2(g)��ƽ���ѹ������2 kPa��7 kPa��36 kPa��36 kPa������Kp��
��1.8�����x��18��CH4(g)��CO2(g)��CO(g)��H2(g)��ƽ���ѹ������2 kPa��7 kPa��36 kPa��36 kPa������Kp��![]() ��
��![]() (kPa)2��
(kPa)2��
(3)�����£�������Һ��NaOH��Һ��ϣ����û����Һ���Դ��ڷֲ����룺
H2C2O4![]() H++HC2O4�� Ka1��
H++HC2O4�� Ka1��![]()
HC2O4��![]() H++C2O42�� Ka2��
H++C2O42�� Ka2��![]()
��![]() ʱ��Ka1��Ka2��
ʱ��Ka1��Ka2��![]() ��
��![]() ��
��![]() ��6��10��3.5 mol/L��pH��2.7��
��6��10��3.5 mol/L��pH��2.7��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����12�֣���֪��I2��2S2O===S4O��2I����������ʵ��ܶȻ��������±���
���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2��10��20 | 2.6��10��39 | 1.7��10��7 | 1.3��10��12 |
(1)ij����CuCl2��Һ�к���������FeCl3��Ϊ�õ�������CuCl2��2H2O���壬���� �����ѧʽ������pH��4��ʹ��Һ�е�Fe3��ת��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3��)�� �����˺�������Һ����������Ũ���ᾧ���ɵõ�CuCl2��2H2O���塣
(2)�ڿ�����ֱ�Ӽ���CuCl2��2H2O����ò���������ˮCuCl2��ԭ���� (�û�ѧ����ʽ��ʾ)����CuCl2��2H2O����õ�������ˮCuCl2�ĺ��������� ��
(3)ijѧϰС��������ӵ��������ⶨ����CuCl2��2H2O���������(��������I��������Ӧ������������)�Ĵ��ȣ��������£�ȡ0.36 g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000 mol/L Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00 mL��
����ѡ�� ���ζ�ָʾ�����ζ��յ�������� ��
��CuCl2��Һ��KI��Ӧ�����ӷ���ʽΪ ��
����������CuCl2��2H2O�������ٷ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A. 0.1 mol NaHSO4�����к��е���������Ϊ0.3NA
B. 1L 1 mo1��L-1��(NH4)2CO3��Һ������NH4+����ĿΪ2NA
C. ����£�22.4L Cl2ͨ��ˮ�У�ת�Ƶĵ�����ΪNA
D. 20g D2O���е�������Ϊ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼��ͭ������ľ�ķ�������ˮ��ɱ����ȣ��о���ѧϰС��������·����Ʊ���ʽ̼��ͭ���������ʵ��̽����
������ͭмΪԭ���Ʊ���ʽ̼��ͭ��װ�����£�
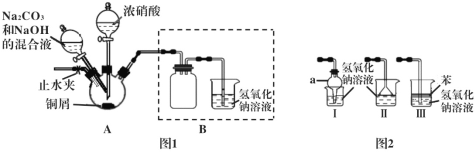
����1 ���Ӻ�װ�ã����װ�õ������ԣ�װҩƷ��
����2 ��������ƿ�м���������Ũ���ᣬʹͭм��ȫ��Ӧ��
����3 ������2��Ӧ�����Һ�м���һ��������Na2CO3��NaOH�Ļ��Һ�����ȡ�
����4 ��������ƿ�еĻ������ˡ�ϴ�ӡ���ɣ���ò��
��֪��������ʽ̼��ͭΪ����ɫ����ɫ�ᾧ��������ᣬ������ˮ����100���ˮ���ֽ⣻
����NO+NO2+2NaOH=2NaNO2+H2O��2NO2+2NaOH=NaNO3+NaNO2+H2O��
NO���ܵ�����NaOH��Һ��Ӧ��
��1������2��Ũ������ͭм��Ӧ�����ӷ���ʽΪ___________________��
��2������2��Ӧһ��ʱ������ֹˮ�У�ͨ��һ��ʱ��Ŀ�����Ŀ����_______��
��3������3��װ��A�ļ��ȷ�ʽ��ò���____________��
��4��װ����������a������Ϊ____��������װ�ò������ͼ1��Bװ�õ���_____����װ����ţ���
��5�������鲽��4��õIJ������Ƿ���NO3-��������Լ�������__________��
��̽����һ���¶��£���ͬ��ԭ����ȶԲ����Ӱ�죬ʵ���������£�
ʵ����� | V[Cu(NO3)2] /mL ��0.5 mo1��L-1�� | V(NaOH) / mL ��0.5 mo1��L-1�� | V(Na2CO3)/ mL ��0.25 mo1��L-1�� | �������� | ������ɫ |
1 | 2.0 | 2.0 | 1.6 | + | dz��ɫ |
2 | 2.0 | 2.0 | 2.0 | + + | dz��ɫ |
3 | 2.0 | 2.0 | 2.4 | + + + | ��ɫ |
4 | 2.0 | 2.0 | 2.8 | + + + | ��ɫ |
ע����+��Խ���ʾ������Խ��
��6�������������ݿɵã��Ʊ���ʽ̼��ͭ��ѵ�ԭ�����n[Cu(NO3)2]:n(NaOH) : n(Na2CO3) =___��
������ɵIJⶨ
��7����ʽ̼��ͭ�ijɷ��ж��֣���ѧʽ�ɱ�ʾΪmCu(OH)2��n CuCO3��Ϊ�ⶨ�������ü�ʽ̼��ͭ����ɣ�ѧϰС��ͬѧȷ��ȡ3.820 g��Ʒ���������������У���ˮ���l00 mL��Һ��ȡl0.00 mL��Һ����ƿ�У�������ˮϡ�ͣ�������ҺpH��3��4�����������KI��2 Cu2+ + 4 I- = 2 CuI�� + I2������0.l000 mol��L-1 Na2S2O3����Һ�ζ���2 S2O32- + I2 = 2I- + S4O62-�����ӽ��յ�ʱ���������ָʾ���������ζ����յ㣬��ɫ��ʧ������ƽ��ʵ����ƽ������Na2S2O3����Һ�����Ϊ35.00 mL���ü�ʽ̼��ͭ�Ļ�ѧʽΪ_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮMgBr2�����ڴ�����ij��ѧС����ʵ����ѡ����ͼ��ʾװ�� (�г�װ���ԣ�����þм��Һ��Ϊԭ���Ʊ���ˮMgBr2��

��֪������Ũ��������£����ȵ�140��ʱ�Ҵ���ˮ��������(C2H5OC2H5)�����ȵ�170��ʱ�Ҵ���ˮ����CH2 = CH2��
�����ѵ��۵�Ϊ34.6�棬�е�Ϊ132�档
��Mg��Br2���ҷ�Ӧ���ų��������ȣ�MgBr2����ǿ��ˮ�ԣ�MgBr2�������ѷ�����Ӧ MgBr2 +3C2H5OC2H5 ![]() MgBr2 3C2H5OC2H5��
MgBr2 3C2H5OC2H5��
ʵ����Ҫ�������£�
I.ѡ����������װ�ã���ȷ���ӣ����װ�õ������ԡ���װ���м���ҩƷ��
II.����װ��A��Ѹ��������140�棬������140�����һ��ʱ�䣬ֹͣ���ȡ�
III.ͨ�����ĵ�������Һ�建������װ��B�У�ֱ����ȫ���롣
IV.װ��B�з�Ӧ��Ϻ�ָ������£����˷�Ӧ����õ�����Һת�����������ƿ�У��ڱ�ˮ����ȴ���������壬�ٹ��˵������Ѻ��廯þ�ֲ�Ʒ��
V.�ñ�ϴ�Ӵֲ�Ʒ����ѹ���ˣ��������Ѻ��廯þ�����������160��ֽ����ˮ MgBr2��
�ش��������⣺
(1)װ��A��ʹ������m���ŵ���________��
(2)����I����ѡװ�õ���ȷ����˳����a________ (��Сд��ĸ)��װ��D��������________��
(3)������װ��Aһ��ʱ��������Ǽ������Ƭ��Ӧ�ò�ȡ����ȷ������________��
(4)����V���ñ�ϴ�������Ѻ��廯þ��Ŀ����________��
(5)����V���ü�ѹ���ˣ�ʹ������ѹǿ���ͣ��Դﵽ��Һ���ٷ��룩������װ�ÿ�������ѹ���˵���________(����ţ���

(6)ʵ�������¶ȿ��Ʋ�����װ��B�л����CH2Br��CH2Br�������ʵ����֤ CH2Br��CH2Br�Ĵ��ڣ��ӷ�Ӧ��Ļ�����з����ᴿ�õ�CH2Br��CH2Br��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��425��ʱ,��ijV L���ܱ������г���2molH2(g)��2mol I2(g)������Ӧ: H2(g)+I2(g)![]() 2HI(g)
2HI(g)![]() =-26.5kJ/mol,��ø����ʵ����ʵ���Ũ����ʱ��仯�Ĺ�ϵ��ͼ��ʾ��
=-26.5kJ/mol,��ø����ʵ����ʵ���Ũ����ʱ��仯�Ĺ�ϵ��ͼ��ʾ��

��ش���������:
(1)V=__________.
(2)�÷�Ӧ�ﵽ������˵�ʱ����____________,��ʱ����ƽ����Ӧ����v(HI)=________________��
(3)�÷�Ӧ�ﵽƽ��״̬ʱ,__________(���������������ų���)������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�д��ڶ��ַ��Ӻ����ӣ������ڲ�ͬ�ķ�Ӧ�б��ֳ���ͬ�����ʡ����н�����ȷ���ǣ� ��
A. ������ɫ������Ƭ�̺���ɫ������ɫ��˵����Cl2����
B. ��Һ��dz����ɫ�����д̼�����ζ��˵����Cl2����
C. �ȼ��������ữ���ټ���AgNO3��Һ�����ɰ�ɫ������˵����Cl������
D. ����NaOH��Һ����ˮ��dz����ɫ��ʧ��˵����HClO����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������и�����������Һ�У�һ���ܴ����������������
A. ��ɫ��Һ��K+ ��Cl- �� Mg2+�� SO42- ��Ag+
B. ��ʹpH��ֽ�ʺ�ɫ����Һ��Na+��NH4+��I����NO3-
C. Na2CO3��Һ��K+��Fe3+��SO42- ��NO3-
D. �����£�Kw/c(H+)��0.1 mol/L����Һ��Na����K����SiO32-��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ�ص�һ��ͬλ��X��ԭ��������ΪA����N�����ӣ�����![]() ԭ�����HmX���ӣ���a��HmX���������ӵ����ʵ����ǣ� ��
ԭ�����HmX���ӣ���a��HmX���������ӵ����ʵ����ǣ� ��
A. ![]() (A-N+m)molB.
(A-N+m)molB. ![]() (A-N)molC.
(A-N)molC. ![]() (A-N)molD.
(A-N)molD. ![]() (A-N+m)mol
(A-N+m)mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com