
【题目】(12分)已知:I2+2S2O===S4O+2I-。相关物质的溶度积常数见下表:
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入 ,(填化学式)调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)= 。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是 (用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是 。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用 作滴定指示剂,滴定终点的现象是 。
②CuCl2溶液与KI反应的离子方程式为 。
③该试样中CuCl2·2H2O的质量百分数为 。
【答案】(12分)(1) CuO或Cu(OH)2或 CuCO3或Cu2(OH)2CO3(1分)2.6×10-9mol·L-1(2分)
(2)2CuCl2·2H2O![]() Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] (2分) 在干燥的HCl气流中加热脱水(1分)
Cu(OH)2·CuCl2+2HCl+2H2O[主要产物写成Cu(OH)2、Cu(OH)Cl、CuO均可] (2分) 在干燥的HCl气流中加热脱水(1分)
(3) ①淀粉溶液(1分) 蓝色褪去,放置一定时间后不复色(1分)
②2Cu2++4I-===2CuI↓+I2(2分) ③95%(2分)
【解析】试题分析:(1)从表上可以看出氢氧化铁的溶度积要远远小于氢氧化铜的溶度积,所以可以通过调节pH的方法除去酸性CuCl2溶液中含有少的量FeCl3,但是不能引入其他杂质,所以可以加入Cu(OH)2或Cu2(OH)2CO3,答案为Cu(OH)2或Cu2(OH)2CO3;pH=4,溶液中c(OH-)=10-10,,溶液中的Fe3+已转化为Fe(OH)3沉淀,所以存在Fe(OH)3![]() Fe3++3OH-平衡,根据
Fe3++3OH-平衡,根据![]() 可以算出,c(Fe3+)= 2.6×10-9mol·L-1,答案为)Cu(OH)2或Cu2(OH)2CO3 , 2.6×10-9mol·L-1
可以算出,c(Fe3+)= 2.6×10-9mol·L-1,答案为)Cu(OH)2或Cu2(OH)2CO3 , 2.6×10-9mol·L-1
(2)由于加热促进了CuCl2的水解,且生成的HCl又易挥发,造成水解完全生成氢氧化铜, 氢氧化铜加热时分解生成氧化铜;由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是:在干燥的HCl气流中加热脱水,答案为2CuCl2·2H2O====Cu(OH)2·CuCl2+2HCl+2H2O,在干燥的HCl气流中加热脱水;
(3)间接碘量法测含有CuCl2·2H2O晶体的试样,反应原理是氯化铜与过量KI反应生成碘单质,反应方程式为:2Cu2++4I-===2CuI↓+I2,碘单质再与Na2S2O3反应:I2+ S2O32-==S4O62-+2 I-,淀粉遇碘变蓝,所以可以选用淀粉作为指示剂,终点时的现象为溶液由蓝色变无色,根据上述方程式得:2 Cu2+~ I2~2 Na2S2O3,则n(CuCl2·2H2O)=n(Na2S2O3)="0.100" 0 mol·L-1x0.02L=0.002mol,故m(CuCl2·2H2O)= n(CuCl2·2H2O)·M(CuCl2·2H2O)= 0.002molx171g/mol=0.342g,样品中CuCl2·2H2O的质量分数为0.342g/0.36gx100%=95%


科目:高中化学 来源: 题型:
【题目】(1)①常温下,.某溶液中由水电离出的c(OH-)=1.0×10-10mol/L,该溶液可以是_________。(填选项)
A. pH=4的CH3COOH B.pH=10的NaOH C. pH=9的 Na2CO3
D. pH=2的 H2SO4 E. pH=4的 NH4C1
(2)常温下,aml/0.lmol/L盐酸与bmL0.lmol/L氨水混合,充分反应,若混合后溶液呈中性,则a____b (填“<”、“>”或“=”)。
(3)常温下,amLpH=3的盐酸与bmLpH=11的氨水混合,充分反应,若a=b,,则反应后溶液中离子浓度从大到小的顺序是___________。
(4)氯化铝水溶液呈酸性,原因是(用离子方程式表示〉:___________。把A1Cl3溶液蒸干,灼烧,最后得到的主要固体产物是___________。
(5)25℃,在0.10 mol/LH2S溶液中,通入HC1气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下图(忽略溶液体积的变化、H2S的挥发)。
① pH=13时,溶液中的 c(H2S)+c(HS-)=_________mol/L。
② 某溶液含 0.020 mol /LMn2+、0.10 mol/LH2S,当溶液pH=_____时,Mn2+开始沉淀。(Ksp(MnS) =2.8×1013)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知:①![]() ;
;
②![]() ;
;
③苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。以下是用苯作原料制备某些化合物的转化关系图:

(1)A的名称是_______,密度比水______(填“小”或“大”)。生成A的方程式是______。
(2)在“![]() ”的所有反应中属于取代反应的是_______(填字母)。
”的所有反应中属于取代反应的是_______(填字母)。
(3)C生成D的反应要一直维持在70~80的温度采用的方法为____________________。
(4)写出A生成B的反应方程式_________________,该反应属于什么反应类型_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一组同学设计了如图装置来一次性完成验证C、Si、S非金属性强弱的实验 研究. 
(1)A中所盛溶液的名称是 .
(2)B仪器的名称是 .
(3)烧杯C中发生反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图所示化合物的说法不正确的是( )。
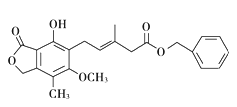
A. 既可以与Br2的CCl4溶液发生加成反应,又可以与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组对乙醇的分子结构进行探究。
猜想一:乙醇结构是CH3CH2OH。
猜想二:乙醇结构是CH3OCH3。制定并实施方案:按右图所示实验装置,测定乙醇与钠反应(放热)生成氢气的体积,并据此计算乙醇分子中能与足量金属钠反应的氢原子的数目。试回答下列问题:

(1)指出实验装置中的错误 _________________________ 。
(2)如果实验装置和操作正确,且结论符合猜想一,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为:_______________________。
(3)如果实验装置和操作正确,且结论符合猜想二,则参加反应的乙醇的物质的量与产生氢气的物质的量之比可能为:____________。
(4)如果实验装置正确,实验结果为2.3g乙醇与足量金属钠反应时产生了标准状况下的氢气约0.56L,则乙醇的结构应为___________,理由是_____________。
(5)该实验获得成功的关键,除了需要纠正图中的装置错误以外,还需注意下列问题中的___________。①装置的气密性良好;②实验开始前准确测定乙醇的量;③氢气的体积测算准确;④广口瓶中水的体积大于560mL;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA (g) +nB (g) ==C (g) +gD (g);△H <0,下列结论中错误的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m: n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com