
【题目】下列有关电解质溶液的说法正确的是( )
A. 向0.1mol/L CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中c(CH3COO-)/[c(CH3COOH). c(OH-)]增大
C. 向盐酸中加入氨水至中性,溶液中c(NH4+)/c(Cl-)>1
D. 用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液,所消耗的醋酸溶液的体积分别为Va和Vb,则Va >10Vb
【答案】D
【解析】
A.向0.1mol/L CH3COOH溶液中加入少量水促进醋酸电离,氢离子物质的量增大,醋酸物质的量减少,则溶液中![]() 增大,故A错误;B.将CH3COONa溶液从20℃升温至30℃,促进CH3COONa的水解,c(CH3COO-)减小,c(CH3COOH)和c(OH-)增大,则溶液中
增大,故A错误;B.将CH3COONa溶液从20℃升温至30℃,促进CH3COONa的水解,c(CH3COO-)减小,c(CH3COOH)和c(OH-)增大,则溶液中![]() 减小,故B错误;C.向盐酸中加入氨水至中性,溶液中电荷守恒为c(NH4+)+c(H+)=c(OH-)+c(Cl-)则c(NH4+)=c(Cl-),
减小,故B错误;C.向盐酸中加入氨水至中性,溶液中电荷守恒为c(NH4+)+c(H+)=c(OH-)+c(Cl-)则c(NH4+)=c(Cl-),![]() =1,故C错误;D.如为pH=3和pH=2的盐酸中和NaOH溶液,则有Va=10Vb,但醋酸为弱电解质,浓度越小,电离程度越大,所以应有Va>10Vb,故D正确;故选D。
=1,故C错误;D.如为pH=3和pH=2的盐酸中和NaOH溶液,则有Va=10Vb,但醋酸为弱电解质,浓度越小,电离程度越大,所以应有Va>10Vb,故D正确;故选D。


科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是
A. 10g H2 和10g O2 B. 5.6L N2和11g CO2
C. 9 g H2O 和0.5 molBr2 D. 224mL H2(标况)和0.1 mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的Na2CO3溶液,下列操作会使溶液浓度偏高的是
A.少量Na2CO3固体残留在称量纸上B.溶解Na2CO3时烧杯中有少量蒸馏水
C.转移时没有洗涤烧杯和玻璃棒D.定容至液面最高处与刻度线相平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )
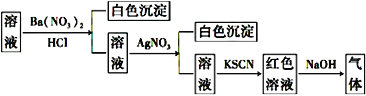
A. 原溶液中一定含有SO42-B. 原溶液中一定含有NH4+
C. 原溶液中一定含有Cl-D. 原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”—钛酸钡(BaTiO3)![]() 的工艺流程如下:
的工艺流程如下:
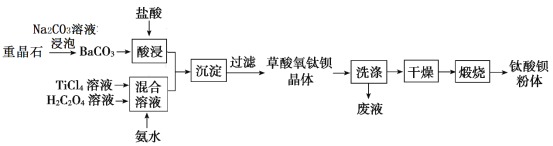
已知:
(1)Ksp(BaSO4)=1.0×10﹣10 ,Ksp(BaCO3)=5.0×10-9
(2)草酸氧钛钡晶体的化学式为 BaTiO(C2O4)2·4H2O
回答下列问题:
(1)为提高BaCO3的酸浸速率,可采取的措施为_________(写出一条)。
(2)配制一定浓度的TiCl4溶液时,通常是将TiCl4(室温下为液体)________________。
(3)用Na2CO3溶液泡重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为BaCO3,此反应的平衡常数K=______(填写计算结果)。若不考虑CO32-的水解,则至少需要使用浓度为_____mol/LNa2CO3溶液浸泡重晶石才能开始该转化过程。
(4)设计实验方案验证草酸氧钛钡晶体已经洗涤干净:______________________________。
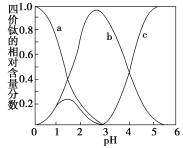
(5)“混合溶液液”环节,钛元素在不同pH下主要以TiOC2O4、TiO(C2O4)22-和TiO(OH)+三种形式存在,如图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则图中曲线a对应钛的形式为_____(填化学式);写出“沉淀”时的离子方程式:___________。
(6)煅烧草酸氧钛钡晶体得到BaTiO3方程式为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中常见的材料可以进行很多科学实验,甚至制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,有关说法正确的是( )

A.铝罐将逐渐被腐蚀
B.碳粒和碳棒上发生的反应为O2+2H2O-4e-=4OH-
C.碳棒应与玩具电机的负极相连
D.该电池工作一段时间后碳棒和碳粒的质量会减轻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是

A. 电极Y为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3+和I-在水溶液中的反应为2I-+2Fe3+![]() I2+2Fe2+。某温度下该反应的正反应速率和I-、Fe3+浓度的关系为v=kcm(I-)·cn(Fe3+)(k为常数)。
I2+2Fe2+。某温度下该反应的正反应速率和I-、Fe3+浓度的关系为v=kcm(I-)·cn(Fe3+)(k为常数)。
c(I-)/mol·L-1 | c(Fe3+)/mol·L-1 | v/mol·L-1·s-1 | |
① | 0.20 | 0.80 | 0.032k |
② | 0.60 | 0.40 | 0.144k |
③ | 0.80 | 0.20 | 0.128k |
由此推知,有关Fe3+、I-的浓度对反应速率影响的判断正确的是 ( )
A. Fe3+浓度对正反应速率的影响程度大于I-浓度的影响程度
B. Fe3+浓度对正反应速率的影响程度小于I-浓度的影响程度
C. Fe3+浓度对正反应速率的影响程度等于I-浓度的影响程度
D. 无法比较
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com