
°æƒø°øƒ≥π§≥ß“‘÷ÿæß Ø(÷˜“™∫¨BaSO4)Œ™‘≠¡œ£¨…˙≤˙°∞µÁ◊”Ã’¥…𧓵÷ß÷˘°±°™Ó—À·±µ(BaTiO3)![]() µƒπ§“’¡˜≥ûÁœ¬£∫
µƒπ§“’¡˜≥ûÁœ¬£∫
“—÷™£∫
(1)Ksp(BaSO4)=1.0°¡10©Å10 £¨Ksp(BaCO3)=5.0°¡10-9
(2)≤ðÀ·—ıÓ—±µæßõƒªØ—ß ΩŒ™ BaTiO(C2O4)2°§4H2O
ªÿ¥œ¬¡–Œ £∫
(1)Œ™Ã·∏þBaCO3µƒÀ·Ω˛ÀŸ¬ £¨ø…≤…»°µƒ¥Î ©Œ™_________(–¥≥ˆ“ªÃı)°£
(2)≈‰÷∆“ª∂®≈®∂»µƒTiCl4»Ð“∫ ±£¨Õ®≥£ «Ω´TiCl4( “Œ¬œ¬Œ™“∫ÃÂ)________________°£
(3)”√Na2CO3»Ð“∫≈ð÷ÿæß Ø(ºŸ…Ë‘”÷ ≤ª”ÎNa2CO3»Ð“∫◊˜”√)£¨¥˝¥ÔµΩ∆Ω∫‚∫Û£¨“∆◊þ…œ≤„«Â“∫£¨÷ÿ∏¥∂ý¥Œ≤Ÿ◊˜£¨Ω´BaSO4◊™ªØŒ™BaCO3£¨¥À∑¥”¶µƒ∆Ω∫‚≥£ ˝K=______(ÃÓ–¥º∆À„Ω·π˚)°£»Ù≤ªøº¬«CO32-µƒÀÆΩ‚£¨‘Ú÷¡…Ÿ–Ë“™ π”√≈®∂»Œ™_____mol/LNa2CO3»Ð“∫Ω˛≈ð÷ÿæß Ø≤≈ƒÐø™ º∏√◊™ªØπ˝≥ð£
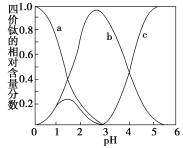
(4)…˺∆ µ—È∑Ω∞∏—È÷§≤ðÀ·—ıÓ—±µæßÓ—æ≠œ¥µ”∏…檣∫______________________________°£
(5)°∞ªÏ∫œ»Ð“∫“∫°±ª∑Ω⁄£¨Ó—‘™Àÿ‘⁄≤ªÕ¨pHœ¬÷˜“™“‘TiOC2O4°¢TiO(C2O4)22-∫ÕTiO(OH)+»˝÷÷–Œ Ω¥Ê‘⁄£¨»ÁÕºÀ˘ æ°£ µº ÷∆±∏𧓒÷–£¨œ»”√∞±ÀƵ˜Ω⁄ªÏ∫œ»Ð“∫µƒpH”⁄2.5°´3÷ƺ‰£¨‘ŸΩ¯––°∞≥¡µÌ°±£¨‘ÚÕº÷–«˙œþa∂‘”¶Ó—µƒ–Œ ΩŒ™_____(Ãѧ Ω)£ª–¥≥ˆ°∞≥¡µÌ°± ±µƒ¿Î◊”∑Ω≥Ã Ω£∫___________°£
(6)Ï—…’≤ðÀ·—ıÓ—±µæßõ√µΩBaTiO3∑Ω≥Ã ΩŒ™£∫__________°£
°æ¥∞∏°øΩ´BaCO3—–≥…∑€ƒ©ªÚ µ±‘ˆ¥Û—ŒÀ·≈®∂»ªÚ µ±º”»»ªÚΩ¡∞˵» »Ð”⁄≈®—ŒÀ·£¨‘Ÿº” ¡øÀÆœ° Õ÷¡À˘–Ë≈®∂»°£ 0.02 5.0°¡10-4 »°…Ÿ–Ì◊Ó∫Û“ª¥Œœ¥µ”“∫£¨µŒ»Îœ°œıÀ·À·ªØµƒœıÀ·“¯£¨ŒÞ≥¡µÌ…˙≥…£¨Àµ√˜æßÓ—æ≠œ¥µ”∏…æª TiOC2O4 TiO(C2O4)22-£´Ba2£´+4H2O=BaTiO(C2O4)2°§4H2O°˝ BaTiO(C2O4)2°§4H2O![]() BaTiO3+2CO°¸+2CO2°¸+4H2O
BaTiO3+2CO°¸+2CO2°¸+4H2O
°æΩ‚Œˆ°ø
(1)∏˘æðŒÔ÷ µƒ¥Ê‘⁄◊¥Ã¨º∞”∞œÏªØ—ß∑¥”¶ÀŸ¬ µƒ“ÚÀÿ∑÷Œˆ£ª
(2)∏√—Œ ««øÀ·»ıºÓ—Œ£¨‘⁄»Ð“∫÷–»ıºÓ—Ù¿Î◊”ÀÆΩ‚£¨¥”“÷÷∆—ŒÀÆΩ‚øº¬«£ª
(3)∏˘æð≥¡µÌµƒ◊™ªØ∆Ω∫‚∑Ω≥Ã Ω È–¥°¢º∆À„£ª
(4)≤ðÀ·—ıÓ—±µæßÃÂ¥”∫¨”–HCl°¢TiCl4»Ð“∫÷–≤˙…˙£¨÷ª“™÷§√˜œ¥µ”“∫÷–ŒÞCl-£¨æÕ÷§√˜œ¥µ”∏…檣ª
(5) °∞ªÏ∫œ»Ð“∫°±ª∑Ω⁄£¨Ó—‘™Àÿ‘⁄≤ªÕ¨pHœ¬÷˜“™“‘TiOC2O4°¢TiO(C2O4)22-∫ÕTiO(OH)+»˝÷÷–Œ Ω¥Ê‘⁄£¨æð°∞≥¡µÌ°± ±…˙≥…≤ðÀ·—ıÓ—±µæßÃÂ÷–∫¨”–TiO(C2O4)22-(º¥bŒ¢¡£)£¨ÀÊ◊≈∞±ÀƵƒ≤ª∂œº”»ÎC2O42-≈®∂»÷Ω•‘ˆ¥Ûµƒ«˜ ∆£¨ø…“‘≈–∂œa∂‘”¶Ó—µƒ–Œ ΩŒ™TiOC2O4£ª‘Ÿ∏˘æð∑¥”¶«∞∫Û∏˜÷÷‘™Àÿµƒ‘≠◊”∏ˆ ˝ ÿ∫„º∞æßõƒªØ—ß Ω È–¥≥ˆœý”¶µƒªØ—ß∑Ω≥Ã Ω£ª
(6)≤ðÀ·—ıÓ—±µæßÃÂÏ—…’µ√µΩBaTiO3£¨Õ¨ ±µ√µΩCO°¢CO2º∞ÀÆ’Ù∆¯°£
(1)—ŒÀ·”ÎBaCO3∑¢…˙∑¥”¶£∫2HCl+BaCO3=BaCl2+H2O+CO2°¸£¨Œ™¡Àº”øÏ∑¥”¶ÀŸ¬ °££¨ø…“‘Ω´πÃÃÂBaCO3—–≥…∑€ƒ©£¨“‘‘ˆ¥ÛΩ”¥•√ʪ˝£ª“≤ø…“‘ µ±‘ˆ¥Û—ŒÀ·≈®∂»ªÚ µ±º”»»…˝∏þ∑¥”¶Œ¬∂»ªÚΩ¡∞˵»µ»£ª
(2) TiCl4 ««øÀ·»ıºÓ—Œ£¨‘⁄»Ð“∫÷–Ti4+ª·∑¢…˙ÀÆΩ‚∑¥”¶£∫Ti4++4H2O![]() Ti(OH)4+4H+£¨ π»Ð“∫±‰ªÎ◊«Œ™¡À≈‰÷∆µ√µΩ≥Œ«ÂµƒTiCl4»Ð“∫£¨Õ¨ ±≤ª“˝»Î‘”÷ ¿Î◊”£¨Õ®≥£ «Ω´TiCl4»Ð”⁄≈®—ŒÀ·÷–£¨»ª∫Û‘Ÿº” ¡øÀÆœ° Õ÷¡À˘–Ë≈®∂»£ª
Ti(OH)4+4H+£¨ π»Ð“∫±‰ªÎ◊«Œ™¡À≈‰÷∆µ√µΩ≥Œ«ÂµƒTiCl4»Ð“∫£¨Õ¨ ±≤ª“˝»Î‘”÷ ¿Î◊”£¨Õ®≥£ «Ω´TiCl4»Ð”⁄≈®—ŒÀ·÷–£¨»ª∫Û‘Ÿº” ¡øÀÆœ° Õ÷¡À˘–Ë≈®∂»£ª
(3) ‘⁄»Ð“∫÷–BaSO4¥Ê‘⁄≥¡µÌ»ÐΩ‚∆Ω∫‚£¨µ±œÚ»Ð“∫÷–º”»Î±•∫ÕNa2CO3»Ð“∫ ±£¨∑¢…˙≥¡µÌ◊™ªØ…˙≥…BaCO3£∫BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)£¨¥˝¥ÔµΩ∆Ω∫‚∫Û£¨“∆◊þ…œ≤„«Â“∫£¨÷ÿ∏¥∂ý¥Œ≤Ÿ◊˜£¨◊Ó÷’BaSO4…˙≥…BaCO3£ª∑¥”¶µƒ∆Ω∫‚≥£ ˝K=
BaCO3(s)+SO42-(aq)£¨¥˝¥ÔµΩ∆Ω∫‚∫Û£¨“∆◊þ…œ≤„«Â“∫£¨÷ÿ∏¥∂ý¥Œ≤Ÿ◊˜£¨◊Ó÷’BaSO4…˙≥…BaCO3£ª∑¥”¶µƒ∆Ω∫‚≥£ ˝K=![]() 0.02£ª‘⁄BaSO4±•∫ջГ∫÷–£¨∏˘æðKsp(BaSO4)=1.0°¡10©Å10ø…÷™c(Ba2+)=1.0°¡10©Å5mol/L£¨≤ªøº¬«CO32-µƒÀÆΩ‚£¨“™ µœ÷≥¡µÌµƒ◊™ªØ£¨‘Úc(Ba2+)c(CO32-)> Ksp(BaCO3)£¨c(CO32-)>5.0°¡10©Å9°¬1.0°¡10©Å5=5.0°¡10-4mol/L£¨º¥÷¡…Ÿ–Ë“™ π”√≈®∂»Œ™5.0°¡10-4mol/LNa2CO3»Ð“∫Ω˛≈ð£ª
0.02£ª‘⁄BaSO4±•∫ջГ∫÷–£¨∏˘æðKsp(BaSO4)=1.0°¡10©Å10ø…÷™c(Ba2+)=1.0°¡10©Å5mol/L£¨≤ªøº¬«CO32-µƒÀÆΩ‚£¨“™ µœ÷≥¡µÌµƒ◊™ªØ£¨‘Úc(Ba2+)c(CO32-)> Ksp(BaCO3)£¨c(CO32-)>5.0°¡10©Å9°¬1.0°¡10©Å5=5.0°¡10-4mol/L£¨º¥÷¡…Ÿ–Ë“™ π”√≈®∂»Œ™5.0°¡10-4mol/LNa2CO3»Ð“∫Ω˛≈ð£ª
(4) HCl°¢TiCl4°¢H2C2O4ªÏ∫œ∑¥”¶≤˙…˙≤ðÀ·—ıÓ—±µæß㨻ÙæßÃÂπ˝¬À∫Ûœ¥µ”∏…檣¨‘Úœ¥µ”“∫÷–≤ª∫¨”–Cl-£¨À˘“‘÷§≤ðÀ·—ıÓ—±µæßÓ—æ≠œ¥µ”∏…檵ƒ∑Ω∑® «»°…Ÿ–Ì◊Ó∫Û“ª¥Œœ¥µ”“∫£¨µŒ»Îœ°œıÀ·À·ªØµƒœıÀ·“¯£¨ŒÞ≥¡µÌ…˙≥…£¨Àµ√˜æßÓ—æ≠œ¥µ”∏…檣ª
(5) °∞ªÏ∫œ»Ð“∫°±ª∑Ω⁄£¨Ó—‘™Àÿ‘⁄≤ªÕ¨pHœ¬÷˜“™“‘TiOC2O4°¢TiO(C2O4)22-∫ÕTiO(OH)+»˝÷÷–Œ Ω¥Ê‘⁄£¨æð°∞≥¡µÌ°± ±…˙≥…≤ðÀ·—ıÓ—±µæßÃÂ÷–∫¨”–TiO(C2O4)22-(º¥bŒ¢¡£)£¨ÀÊ◊≈∞±ÀƵƒ≤ª∂œº”»Î£¨C2O42-≈®∂»÷Ω•‘ˆ¥Ûµƒ«˜ ∆ø…“‘≈–∂œa∂‘”¶Ó—µƒ–Œ ΩŒ™TiOC2O4£¨b∂‘”¶Ó—µƒ–Œ ΩŒ™TiO(C2O4)22-£ªc∂‘”¶Ó—µƒ–Œ ΩŒ™TiO(OH)+£ª‘⁄°∞≥¡µÌ°± ±µƒ¿Î◊”∑Ω≥Ã ΩŒ™£∫TiO(C2O4)22-£´Ba2£´+4H2O=BaTiO(C2O4)2°§4H2O°˝
(6)≤ðÀ·—ıÓ—±µæßÃÂÏ—…’µ√µΩBaTiO3£¨Õ¨ ±µ√µΩCO°¢CO2º∞ÀÆ’Ù∆¯°£Ï—…’≤ðÀ·—ıÓ—±µæßõ√µΩBaTiO3∑Ω≥Ã ΩŒ™BaTiO(C2O4)2°§4H2O![]() BaTiO3+2CO°¸+2CO2°¸+4H2O°£
BaTiO3+2CO°¸+2CO2°¸+4H2O°£



| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¿˚”√»ÁÕºÀ˘ æ◊∞÷√Ω¯–– µ—È£¨ƒÐ µœ÷ µ—ȃøµƒµƒ «£®±ÿ“™ ±ø…º”»»£©
—°œÓ | µ—ȃøµƒ | º◊ | ““ | ±˚ |
|
A | ÷§√˜≈®¡ÚÀ·æþ”–«ø—ıªØ–‘ | ≈®¡ÚÀ· | ú∑€ | ‰ÂÀÆ | |
B | —È÷§Cl2ŒÞ∆Ø∞◊–‘ | ≈®—ŒÀ· | MnO2 | ∏…‘Ôµƒ∫Ï…´≤ºÃı | |
C | —È÷§NH3»Ð”⁄ÀÆœ‘ºÓ–‘ | ≈®∞±ÀÆ | ºÓ ت“ | ™»Ûµƒ¿∂…´ Ø»Ô ‘÷Ω | |
D | ±»ΩœH2CO3∫ÕH2SiO3µƒÀ·–‘ | ≈À·»Ð“∫ | úÀ·ƒ∆ | πËÀ·ƒ∆»Ð“∫ |
A. A B. B C. C D. D
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø¬»∆¯ «“ª÷÷÷ÿ“™µƒªØ—ߌÔ÷ £¨‘⁄…˙≤˙∫Õ…˙ªÓ÷–”–∂ý÷÷”√Õæ£∫
£®1£©¥”∫£ÀÆ÷–ªÒµ√ ≥—Œµƒ∑Ω∑®≥∆Œ™___________°£NaClµƒµÁ◊” Ω «________°£
£®2£© µ—È “µÁΩ‚±•∫Õ ≥—ŒÀƵƒ◊∞÷√»Áœ¬ÕºÀ˘ æ°£œ¬¡–≈–∂œ’˝»∑µƒ «_________£®—°ÃÓ±ý∫≈£©°£

A£ÆµÁº´aŒ™“ıº´
B£ÆµÁº´b…œ∑¢…˙¡Àªπ‘≠∑¥”¶
C£Æ—Ùº´∏ΩΩ¸»Ð“∫±‰∫Ï
D£Æ“ıº´≤˙…˙ª∆¬Ã…´∆¯ÃÂ
£®3£©π§“µ…œ”√µÁΩ‚±•∫Õ ≥—ŒÀƵƒ∑Ω∑®÷∆»°¬»∆¯°£–¥≥ˆ∏√∑¥”¶µƒªØ—ß∑Ω≥Ã Ω£∫________________________________________________________£¨»Ùµ√µΩ¬»∆¯1.12L£®±Í◊º◊¥øˆœ¬£© ±£¨◊™“∆µƒµÁ◊” ˝Œ™______mol°£
£®4£©µÁΩ‚ ±”¶±Ð√‚¡Ωº´≤˙ŒÔœýª•Ω”¥•£¨∑Ò‘Úø…ƒÐ∑¢…˙∏±∑¥”¶°£–¥≥ˆ≤˙ŒÔ÷–“ª÷÷µ•÷ ”Γª÷÷ªØ∫œŒÔ∑¥”¶µƒªØ—ß∑Ω≥Ã Ω£∫_______________________________ °£
£®5£©¬»∆¯”–∂棨µ´ «“≤ø…“‘”√¿¥œ˚∂浃‘≠“Ú «_________________________°£
£®6£©ƒ≥Õ¨—ß”√¬»∆¯◊ˆ¡À»Áœ¬ µ—È£∫
¢ŸœÚ ¢”–KI»Ð“∫µƒ ‘πÐ÷–µŒº”…Ÿ¡ø¬»ÀÆ∫Û‘Ÿº”»Î…Ÿ–ÌCCl4£¨’Òµ¥£¨æ≤÷√∫Ûø…π€≤ϵΩ______________________________°£
¢⁄»Áπ˚ºÃ–¯œÚ ‘πÐ÷–µŒº”¬»ÀÆ£¨’Òµ¥£¨CCl4≤„÷–—’…´ª·÷Ω•±‰«≥£¨◊Ó∫Û±‰≥…ŒÞ…´°£‘Úœ¬¡–Àµ∑®’˝»∑µƒ «___________
a°¢CCl4≤„÷–»Ð÷ ±ª—ıªØ b°¢CCl4±ª—ıªØ
c°¢CCl4≤„÷–»Ð÷ ±ªªπ‘≠ d°¢CCl4±ªªπ‘≠
£®7£©«‚∆¯ «“ª÷÷«ÂΩýƒÐ‘¥£¨”–»À÷“ÈÕ®π˝µÁΩ‚±•∫Õ ≥—ŒÀÆ¥Ûπʃ£…˙≤˙«‚∆¯°£ƒ„ «∑ÒÕ¨“‚∏√π€µ„£ø«Î”√Œƒ◊÷◊˜ºÚ“™Ω‚ Õ°£______________________________________________
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øµ™—ıªØŒÔ£®NO2£© «“ª÷÷÷˜“™µƒ¥Û∆¯Œ€»æŒÔ£¨±ÿ–ÎΩ¯––¥¶¿Ì°£
£®1£©∆˚≥µ∑¢∂ت˙π§◊˜ ±ª·“˝∑¢N2∫ÕO2∑¥”¶…˙≥…NO£¨∆‰∑¥”¶π˝≥Ã÷–µƒƒÐ¡ø±‰ªØ»Áœ¬£∫
∑¥”¶ | N2(g)°˙2N(g) | O2(g)°˙2O(g) | N(g)£´O(g)°˙NO(g) |
∑¥”¶»» | °˜H1 | °˜H2 | °˜H3 |
»»¡ø÷µkJ/mol | 945 | 498 | 630 |
¢Ÿ°˜H1___0£¨°˜H3____0°££®ÃÓ°∞>°±ªÚ°∞<°±£©
¢⁄N2£®g£©+O2£®g£©=2NO£®g£©°˜H=____kJ°§mol-1°£
£®2£©¿˚”√º◊ÕÈ¥þªØªπ‘≠µ™—ıªØŒÔ°£“—÷™£∫
CH4£®g£©+4NO2£®g£©==4NO£®g£©+CO2£®g£©+2H2O£®g£©°˜H=-574kJ°§mol-l
CH4£®g£©+4NO£®g£©==2N2£®g£©+CO2£®g£©+2H2O£®g£©AH=-1160 kJ°§mol-l
H2O£®l£©=H2O£®g£©°˜H=+44kJ°§mol-l
CH4”ÎNO2∑¥”¶…˙≥…N2∫ÕH2O(l)µƒ»»ªØ—ß∑Ω≥Ã ΩŒ™_______°£
£®3£©«±Õß÷– π”√µƒ“∫µ™-“∫—ı»º¡œµÁ≥ÿπ§◊˜‘≠¿Ì»ÁÕºÀ˘ æ£∫

¢ŸµÁº´a√˚≥∆ «______°£
¢⁄µÁΩ‚÷ »Ð“∫÷–OH-¿Î◊”œÚ_____“∆∂Ø£®ÃÓ°∞µÁº´a°±ªÚ°∞µÁº´b°±£©°£
¢€µÁº´bµƒµÁº´∑¥”¶ ΩŒ™_____°£
£®4£©ø…Õ®π˝NH3”ÎNaClO∑¥”¶¿¥÷∆µ√ªº˝»º¡œÎ¬£®N2H4£©°£∏√∑¥”¶µƒªØ—ß∑¥”¶∑Ω≥Ã Ω «_____°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–”–πÿµÁΩ‚÷ »Ð“∫µƒÀµ∑®’˝»∑µƒ «( )
A. œÚ0.1mol/L CH3COOH»Ð“∫÷–º”»Î…Ÿ¡øÀÆ£¨»Ð“∫÷–c(H+)/c(CH3COOH)ºı–°
B. Ω´CH3COONa»Ð“∫¥”20°Ê…˝Œ¬÷¡30°Ê£¨»Ð“∫÷–c(CH3COO-)/[c(CH3COOH). c(OH-)]‘ˆ¥Û
C. œÚ—ŒÀ·÷–º”»Î∞±ÀÆ÷¡÷––‘£¨»Ð“∫÷–c(NH4+)/c(Cl-)£æ1
D. ”√pH=3∫ÕpH=2µƒ¥◊À·»Ð“∫÷–∫Õ∫¨µ»¡øNaOHµƒ»Ð“∫£¨À˘œ˚∫ƒµƒ¥◊À·»Ð“∫µƒÃª˝∑÷±Œ™Va∫ÕVb£¨‘ÚVa >10Vb
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø‘⁄‘™Àÿ÷Ð∆⁄±Ì÷–£¨‘™Àÿ–‘÷ ÀÊ‘≠◊”–Ú ˝µƒµð‘ˆ≥ œ÷÷Ð∆⁄–‘±‰ªØµƒ±æ÷ ‘≠“Ú «£® £©
A.÷–◊” ˝÷Ω•‘ˆ∂ý
B.œý∂‘‘≠◊”÷ ¡ø÷Ω•‘ˆ¥Û
C.∫ÀÕ‚µÁ◊”≈≈≤º≥ œ÷÷Ð∆⁄–‘±‰ªØ
D.‘™ÀÿªØ∫œº€≥ œ÷÷Ð∆⁄–‘±‰ªØ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–πÿ”⁄√∫µƒ∏…¡Ûµƒ– ˆ’˝»∑µƒ «£® £©
¢Ÿ√∫º”«ø»»∂¯∑÷Ω‚µƒπ˝≥ÃæÕΩ–√∫µƒ∏…¡Û
¢⁄√∫∏…¡Ûø…“‘µ√µΩ“±Ω”√µƒ”≈÷ ΩπÃø
¢€√∫µƒ∏…¡Û∫Õ Ø”Õµƒ∑÷¡Ûµƒ±æ÷ «¯±£∫∏…¡Û «ªØ—ß±‰ªØ£¨∂¯∑÷¡Û «ŒÔ¿Ì±‰ªØ
¢Ð∑”¿ý°¢ð¡ø…”…√∫µƒ∏…¡Ûµ√µΩ£¨∆‰¥Ê‘⁄”⁄√∫∏…¡ÛÀ˘µ√µƒΩπ¬Ø∆¯÷–
A.¢Ÿ¢⁄B.¢Ÿ¢€C.¢⁄¢€D.¢⁄¢Ð
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–πÿ”⁄![]() (I)°¢
(I)°¢![]() (II)°¢
(II)°¢![]() (III)°¢
(III)°¢![]() (IV)ªØ∫œŒÔµƒÀµ∑®’˝»∑µƒ «
(IV)ªØ∫œŒÔµƒÀµ∑®’˝»∑µƒ «
A. ¢Ò°¢¢Ú°¢¢Û°¢¢Ùµƒ∑–µ„“¿¥Œ…˝∏þ B. ¢Ò°¢¢Ûµƒ“ª¬»¥˙ŒÔæ˘÷ª”–Àƒ÷÷
C. ¢Ú°¢¢Û÷–ú‘≠◊”ø…ƒÐ∂º¥¶”⁄Õ¨“ª∆Ω√Ê D. ¢Û°¢¢Ù∂º Ù”⁄∑ºœ„◊ªØ∫œŒÔ£¨ª•Œ™Õ¨œµŒÔ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øœ¬¡–◊∞÷√ªÚ≤Ÿ◊˜ƒÐ¥ÔµΩƒøµƒµƒ «


A. ◊∞÷√¢Ÿ”√”⁄≤‚∂®…˙≥…«‚∆¯µƒÀŸ¬
B. ◊∞÷√¢⁄“¿æðÕ …´øϬ˝±»Ωœ≈®∂»∂‘∑¥”¶ÀŸ¬ µƒ”∞œÏ
C. ◊∞÷√¢€“¿æðUπÐ¡Ω±þ“∫√ʵƒ∏þµÕ≈–∂œNa∫ÕÀÆ∑¥”¶µƒ»»–ß”¶
D. ◊∞÷√¢Ð“¿æð≥ˆœ÷ªÎ◊«µƒøϬ˝±»ΩœŒ¬∂»∂‘∑¥”¶ÀŸ¬ µƒ”∞œÏ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
π˙º —ß–£”≈—° - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com