
【题目】利用如图所示装置进行实验,能实现实验目的的是(必要时可加热)
选项 | 实验目的 | 甲 | 乙 | 丙 |
|
A | 证明浓硫酸具有强氧化性 | 浓硫酸 | 碳粉 | 溴水 | |
B | 验证Cl2无漂白性 | 浓盐酸 | MnO2 | 干燥的红色布条 | |
C | 验证NH3溶于水显碱性 | 浓氨水 | 碱石灰 | 湿润的蓝色石蕊试纸 | |
D | 比较H2CO3和H2SiO3的酸性 | 硼酸溶液 | 碳酸钠 | 硅酸钠溶液 |
A. A B. B C. C D. D
科目:高中化学 来源: 题型:
【题目】一种比黄金还要贵重的18O2气体不久在我国兰州近代物理研究所制备成功,1mol这种18O2气体含有中子的物质的量为( )
A. 36 mol B. 20mol C. 16 mol D. 10mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,圆底烧瓶中盛有 0.18g 镁条,加入 10.00mL2.00mol/L 的硫酸溶液 反应完全后,产生氢气 180mL。
(1)根据实验数据计算,气体的摩尔体积为_____。
(2)反应过程中,装置内空气没有排除,空气的体积对实验结果____(填“有”或“无”)影响,请简述理由:________
(3)有同学认为:若镁条中混有杂质,则实验结果会偏低。请列举实例分析该同学的观点是否正确?____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是
A. 10g H2 和10g O2 B. 5.6L N2和11g CO2
C. 9 g H2O 和0.5 molBr2 D. 224mL H2(标况)和0.1 mol N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g) ⊿ H1= + 67.7kJ/mol;
N2H4(g)+O2(g)= N2(g)+2H2O(g) ⊿ H2= - 534kJ/mol;
2H2(g)+ O2(g)= 2H2O (g) ⊿ H3= - 484kJ/mol;
H2(g)+F2(g)=2HF(g) ⊿ H4= - 538kJ/mol
①写出N2H4与 NO2反应的热化学方程式______________________,
②写出N2H4与F2反应的热化学方程式__________________________
(2)已知反应:Cl2+2HBr===Br2+2HCl。
Ⅰ.当有0.2 mol HCl生成时放出8.1 kJ的热量。
Ⅱ.其能量变化示意图如图:

由上述数据判断断开1 mol H—Cl 键与断开 1 mol H—Br键所需能量相差约为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较工业合成氨与接触法制硫酸中SO2催化氧化的生产过程,下列说法中错误的是( )
A.这两个生产过程中,都使用了合适的催化剂
B.都选择了较高的温度
C.都采用了使其中一种原料过量以提高另一种原料利用率的方法
D.都采用了高压的生产条件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。E是具有果香气味的液体。A、B、C、D、E在一定条件下存在如图转化关系(部分反应条件、产物被省略)

请回答下列问题:
(1)工业上,由石油获得白蜡油的方法是___。
(2)丁烷是由石蜡油求得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基(﹣CH3),则这种同分异构体的结构简式是___。
(3)反应B→C反应发生需要的条件为___,D物质中官能团的名称是___。
(4)写出B+D→E的化学方程式___;该反应的速率比较缓慢,实验中为了提高该反应的速率,通常采取的措施有___(写出其中一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”—钛酸钡(BaTiO3)![]() 的工艺流程如下:
的工艺流程如下:
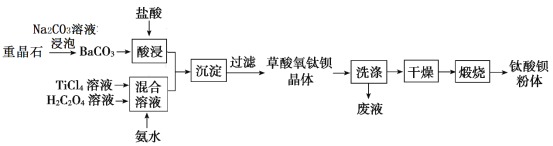
已知:
(1)Ksp(BaSO4)=1.0×10﹣10 ,Ksp(BaCO3)=5.0×10-9
(2)草酸氧钛钡晶体的化学式为 BaTiO(C2O4)2·4H2O
回答下列问题:
(1)为提高BaCO3的酸浸速率,可采取的措施为_________(写出一条)。
(2)配制一定浓度的TiCl4溶液时,通常是将TiCl4(室温下为液体)________________。
(3)用Na2CO3溶液泡重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为BaCO3,此反应的平衡常数K=______(填写计算结果)。若不考虑CO32-的水解,则至少需要使用浓度为_____mol/LNa2CO3溶液浸泡重晶石才能开始该转化过程。
(4)设计实验方案验证草酸氧钛钡晶体已经洗涤干净:______________________________。
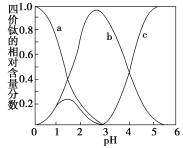
(5)“混合溶液液”环节,钛元素在不同pH下主要以TiOC2O4、TiO(C2O4)22-和TiO(OH)+三种形式存在,如图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则图中曲线a对应钛的形式为_____(填化学式);写出“沉淀”时的离子方程式:___________。
(6)煅烧草酸氧钛钡晶体得到BaTiO3方程式为:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com