
ЁОЬтФПЁПЃЈ1ЃЉЗЂЩфЮРаЧгУN2H4ЮЊШМСЯ,NO2ЮЊбѕЛЏМС,СНепЗДгІЩњГЩN2КЭЫЎеєЦј, вбжЊ
N2(g)+2O2(g)=2NO2(g) ЈS H1ЃН ЃЋ 67.7kJ/molЃЛ
N2H4(g)+O2(g)= N2(g)+2H2O(g) ЈS H2ЃН Ѓ 534kJ/molЃЛ
2H2(g)+ O2(g)= 2H2O (g) ЈS H3ЃН Ѓ 484kJ/molЃЛ
H2(g)+F2(g)=2HF(g) ЈS H4ЃН Ѓ 538kJ/mol
ЂйаДГіN2H4гы NO2ЗДгІЕФШШЛЏбЇЗНГЬЪН______________________,
ЂкаДГіN2H4гыF2ЗДгІЕФШШЛЏбЇЗНГЬЪН__________________________
ЃЈ2ЃЉвбжЊЗДгІЃКCl2ЃЋ2HBr===Br2ЃЋ2HClЁЃ
Ђё.ЕБга0.2 mol HClЩњГЩЪБЗХГі8.1 kJЕФШШСПЁЃ
Ђђ.ЦфФмСПБфЛЏЪОвтЭМШчЭМЃК

гЩЩЯЪіЪ§ОнХаЖЯЖЯПЊ1 mol HЁЊCl МќгыЖЯПЊ 1 mol HЁЊBrМќЫљашФмСПЯрВюдМЮЊ________kJЁЃ
ЁОД№АИЁПN2H4(g)+ 2NO2(g)= 3N2(g)+ 4H2O(g) ЈS H ЃН-1135.7 kJ/mol N2H4(g) +2F2(g)= N2(g)+4HF(g) ЈS H ЃН Ѓ 1126kJ/molЁЃ 62
ЁОНтЮіЁП
ЃЈ1ЃЉЂйN2(g)+2O2(g)=2NO2(g) ЈS H1 ЃН ЃЋ 67.7kJ/molЃЛ
ЂкN2H4(g)+O2(g)= N2(g)+2H2O(g) ЈS H2 ЃН Ѓ 534kJ/molЃЛ
Ђл2H2(g)+ O2(g)= 2H2O (g) ЈS H3 ЃН Ѓ 484kJ/molЃЛ
ЂмH2(g)+F2(g)=2HF(g) ЈS H4 ЃН Ѓ 538kJ/molЃЛ
iИљОнИЧЫЙЖЈТЩ: ЂкЁС2-ЂйЕУЕН: N2H4(g)+ 2NO2(g)=3N2(g)+4H2O(g) ЈSHЃН-1135.7 kJ/molЃЛзлЩЯЫљЪіЃЌБОЬтД№АИЪЧЃКN2H4(g)+ 2NO2(g)=3N2(g)+4H2O(g) ЈSH ЃН-1135.7 kJ/molЁЃ
iiИљОнИЧЫЙЖЈТЩЂк-Ђл+2ЁСЂмЃЌЕУЕНШШЛЏбЇЗНГЬЪНЮЊЃКN2H4(g) +2F2(g)=N2(g)+4HF(g) ЈSH ЃНЃ1126kJ/molЃЛзлЩЯЫљЪіЃЌБОЬтД№АИЪЧЃКN2H4(g) +2F2(g)= N2(g)+4HF(g) ЈSH ЃНЃ 1126kJ/molЁЃ
ЃЈ2ЃЉИљОнЕБга0.2mol HClЩњГЩЪБЗХГі8.1kJЕФШШСПЃЌЫљвд Cl2ЃЈgЃЉ+2HBrЃЈgЃЉЈTBr2ЃЈgЃЉ+2HClЃЈgЃЉЁїH=Љ81 kJmolЉ1ЃЛ243+ЁЦ2molHЉBrЉ200ЉЁЦ2molHЉClЈTЉ81 kJmolЉ1ЃЌЁЦ2molHЉClЉЁЦ2molHЉBr=124kJЃЌЫљвдЖЯПЊ1mol HЉCl МќгыЖЯПЊ 1mol HЉBrМќЫљашФмСПЯрВюдМЮЊ62kJЃЛзлЩЯЫљЪіЃЌБОЬтД№АИЪЧЃК62ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПВЛФмгУРеЯФЬиСадРэНтЪЭЕФЪЧ
A. ЪЙгУЬњДЅУНЃЌМгПьКЯГЩАБЗДгІЫйТЪ B. ЪЕбщЪвгУХХБЅКЭЪГбЮЫЎЗЈЪеМЏТШЦј
C. ДђПЊЦћЫЎЦПИЧЃЌМДгаДѓСПыХнвнГі D. ЮТЖШЩ§ИпЃЌДПЫЎжаЕФH+ХЈЖШдіДѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвЯђ 0.783g MnO2 жаМгШы 20mL36.5%ЃЈІб=1.18g/cm3 ЃЉХЈбЮЫсКѓЃЌЙВШШжЦШЁ Cl2ЃЎЗДгІЗНГЬЪНЮЊЃКMnO2+4HClMnCl2+Cl2+2H2OЃЌШєЗДгІКѓШмвКЬхЛ§ШдЮЊ 20mLЃЌдђЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
A.ЗДгІЯћКФ HCl ЮяжЪЕФСПЮЊ 0.236mol
B.ЗДгІЩњГЩ Cl2 ЦјЬхЕФЬхЛ§ЮЊ 201.6mL
C.ШєШЁ 2mL ЗДгІКѓЕФШмвКЃЌМгШызуСП AgNO3ЃЌПЩВњЩњГСЕэ 2.87g
D.ШєШЁ 2mL ЗДгІКѓЕФШмвКЃЌМгШы 2.0mol/L ЕФ NaOHЃЌЕБГСЕэДяЕНзюДѓжЕЪБЃЌЯћКФ NaOH ШмвКЕФЬхЛ§ЮЊ10.9mL
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПCO2ЕШЮТЪвЦјЬхЕФХХЗХЫљДјРДЕФЮТЪваЇгІвбОЖдШЫРрЕФЩњДцЛЗОГВњЩњКмДѓгАЯьЁЃCO2ЕФРћгУвВГЩЮЊШЫУЧбаОПЕФШШЕуЁЃвдCO2КЭH2ЮЊдСЯКЯГЩМзДМММЪѕЛёЕУгІгУЁЃ
ЃЈ1ЃЉвбжЊCH3OH (g)+![]() O2(g)===CO2(g)+2H2O(l ) ЁїH1=Ѓ363 kJ/mol
O2(g)===CO2(g)+2H2O(l ) ЁїH1=Ѓ363 kJ/mol
2H2(g)+O2(g)===2H2O(1) ЁїH2=Ѓ571.6kJ/mol
H2O(1)====H2O(g) ЁїH3=+44 kJ/ mol
дђCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ЕФЗДгІШШЁїH=___________ЁЃ
CH3OH(g)+H2O(g)ЕФЗДгІШШЁїH=___________ЁЃ
ЃЈ2ЃЉИУЗДгІГЃдк230~280ЁцЁЂ1.5MPaЬѕМўЯТНјааЁЃВЩгУДпЛЏМСжївЊзщЗжЮЊCuO-ZnO-Al2O3ЁЃДпЛЏМСЛюадзщЗжЮЊЕЅжЪЭЃЌвђДЫЗДгІЧАвЊЭЈЧтЦјЛЙдЁЃаДГіЕУЕНЛюадзщЗжЕФЗДгІЕФЛЏбЇЗНГЬЪНЃК__________________________________________ЁЃЪЙгУВЛЭЌДпЛЏМСЪБЃЌИУЗДгІЗДгІШШЁїH__________(ЬюЁАЯрЭЌЁБЛђЁАВЛЭЌЁБ)
ЃЈ3ЃЉИУЗДгІПЩвдПДзївдЯТСНИіЗДгІЕФЕўМгЃК
CO2(g)+H2(g)![]() CO(g)+H2O(g)ЃЌЦНКтГЃЪ§K1ЃЛ
CO(g)+H2O(g)ЃЌЦНКтГЃЪ§K1ЃЛ
CO(g)+2H2(g)![]() CH3OH(g)ЃЌЦНКтГЃЪ§K2ЃЛ
CH3OH(g)ЃЌЦНКтГЃЪ§K2ЃЛ
дђCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ЕФЦНКтГЃЪ§K=___________(гУКЌK1ЁЂK2ЕФДњЪ§ЪНБэЪО)
CH3OH(g)+H2O(g)ЕФЦНКтГЃЪ§K=___________(гУКЌK1ЁЂK2ЕФДњЪ§ЪНБэЪО)
ЃЈ4ЃЉЗДгІЙ§ГЬжаЃЌЗЂЯжЮВЦјжазмЛсКЌгавЛЖЈХЈЖШЕФCOЃЌЮЊСЫМѕЩйЦфХЈЖШЃЌПЩвдВЩШЁЕФДыЪЉЮЊ_________________________________(аДвЛЬѕМДПЩ)
ЃЈ5ЃЉЮЊСЫЬсИпЗДгІЫйТЪЃЌВЩШЁЕФДыЪЉПЩвдга___________ЁЃ
A.ЪЙгУИпаЇДпЛЏМС B.дкНЯИпбЙЧПЯТНјаа C.НЕЕЭбЙЧП D.ГфШыИпХЈЖШCO2
ЃЈ6ЃЉгаШЫбаОПСЫгУЕчЛЏбЇЗНЗЈАбCO2зЊЛЏЮЊCH3OHЃЌЦфдРэШчЭМЫљЪОЃК
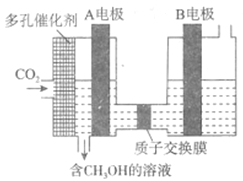
дђЭМжаAЕчМЋНгЕчдД___________МЋЁЃвбжЊBЕчМЋЮЊЖшадЕчМЋЃЌдђдкЫЎШмвКжаЃЌИУМЋЕФЕчМЋЗДгІЮЊ______________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУШчЭМЫљЪОзАжУНјааЪЕбщЃЌФмЪЕЯжЪЕбщФПЕФЕФЪЧЃЈБивЊЪБПЩМгШШЃЉ
бЁЯю | ЪЕбщФПЕФ | Мз | вв | Бћ |
|
A | жЄУїХЈСђЫсОпгаЧПбѕЛЏад | ХЈСђЫс | ЬМЗл | фхЫЎ | |
B | бщжЄCl2ЮоЦЏАзад | ХЈбЮЫс | MnO2 | ИЩдяЕФКьЩЋВМЬѕ | |
C | бщжЄNH3ШмгкЫЎЯдМюад | ХЈАБЫЎ | МюЪЏЛв | ЪЊШѓЕФРЖЩЋЪЏШяЪджН | |
D | БШНЯH2CO3КЭH2SiO3ЕФЫсад | Х№ЫсШмвК | ЬМЫсФЦ | ЙшЫсФЦШмвК |
A. A B. B C. C D. D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЗДгІ2HI(g)![]() H2(g) +I2(g)ЕФФмСПБфЛЏШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
H2(g) +I2(g)ЕФФмСПБфЛЏШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. ГЃЮТЯТЃЌЯђЬхЛ§ЮЊVLЕФШнЦїжаГфШы2mol HIЃЈgЃЉГфЗжЗДгІЃЌПЩЮќЪе12.5kJЕФШШСП
B. МгШыДпЛЏМСЃЌЗжзгЕФФмСПВЛБфЃЌЕЋЕЅЮЛЬхЛ§ЛюЛЏЗжзгЪ§діЖрЃЌЫйТЪМгПь
C. ЦфЫћЬѕМўВЛБфЃЌЩ§ИпЮТЖШЃЌЗДгІЫйТЪМгПьЃЌHIЗжНтТЪВЛБф
D. H2(g) +I2(g)![]() 2HI(g)ЕФЛюЛЏФмEaЮЊ12.5kJЁЄmol1
2HI(g)ЕФЛюЛЏФмEaЮЊ12.5kJЁЄmol1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕБЙтЪјЭЈЙ§ЯТСаЗжЩЂЯЕЪБЃЌФмЙлВьЕНЖЁДяЖћаЇгІЕФЪЧЃЈ ЃЉ
A.есЬЧШмвКB.СђЫсЭШмвКC.ЧтбѕЛЏЬњНКЬхD.БЅКЭЪГбЮЫЎ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдквЛЖЈЮТЖШЯТЃЌБљДзЫсМгЫЎЯЁЪЭЙ§ГЬжаЃЌШмвКЕФЕМЕчФмСІIЫцМгШыЫЎЕФЬхЛ§VБфЛЏЕФЧњЯпШчЭМЫљЪОЁЃЧыЛиД№ЃК

ЃЈ1ЃЉЁАOЁБЕуЕМЕчФмСІЮЊ0ЕФРэгЩЪЧ_________________________ЁЃ
ЃЈ2ЃЉaЁЂbЁЂcШ§ЕуДІЃЌШмвКЕФc(HЃЋ)гЩаЁЕНДѓЕФЫГађЮЊ____________ЁЃ
ЃЈ3ЃЉaЁЂbЁЂcШ§ЕуДІЃЌЕчРыГЬЖШзюДѓЕФЪЧ________ЁЃ
ЃЈ4ЃЉШєНЋcЕуШмвКжаc(CH3COOЃ)діДѓЃЌc(HЃЋ)МѕаЁЃЌПЩВЩШЁЕФДыЪЉЪЧ:
Ђй____________________________________________________ЃЛ
Ђк___________________________________________________ЃЛ
Ђл___________________________________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкдЊЫижмЦкБэжаЃЌдЊЫиаджЪЫцдзгађЪ§ЕФЕндіГЪЯжжмЦкадБфЛЏЕФБОжЪдвђЪЧЃЈ ЃЉ
A.жазгЪ§ж№НЅдіЖр
B.ЯрЖддзгжЪСПж№НЅдіДѓ
C.КЫЭтЕчзгХХВМГЪЯжжмЦкадБфЛЏ
D.дЊЫиЛЏКЯМлГЪЯжжмЦкадБфЛЏ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com