
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:

(1)“O”点导电能力为0的理由是_________________________。
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为____________。
(3)a、b、c三点处,电离程度最大的是________。
(4)若将c点溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施是:
①____________________________________________________;
②___________________________________________________;
③___________________________________________________。
【答案】在“O”点处醋酸未电离,无离子存在c<a<bc加少量NaOH固体加少量Na2CO3固体加入Zn、Mg等金属
【解析】
溶液的导电性与离子浓度有关,离子浓度越大,导电性越强;导电能力越强,离子浓度越大,氢离子浓度越大;溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大;使c(CH3COO-)增大,溶液c(H+)减小,可以加如碱、比醋酸弱的酸的盐、活泼金属等。
溶液的导电能力主要由离子浓度来决定,题目中的图象说明冰醋酸加水稀释过程中,离子浓度随着水的加入先逐渐增大到最大值又逐渐减小,故c(H+)在b点最大,c点最小,这是因为c(H+)=(n(H+))/(V(aq)),加水稀释,醋酸的电离平衡正向移动,n(H+)增大使c(H+)有增大的趋势,而V(aq)增大使c(H+)有减小的趋势,c(H+)是增大还是减小,取决于这两种趋势中哪一种占主导地位。在“O”点时,未加水,只有醋酸,因醋酸未发生电离,没有自由移动的离子存在,故不能导电;要使CH3COO-的浓度增大同时使H+浓度减小,可通过加入强碱、能与醋酸反应的盐、活泼金属等使醋酸的电离平衡正向移动。


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:
【题目】三氯化碘(IC13)在药物合成中用途非常广泛。已知ICl3熔点33℃,沸点73℃,有吸湿性,遇水易水解。某小组同学用下列装置制取ICl3(部分夹持和加热装置省略)。
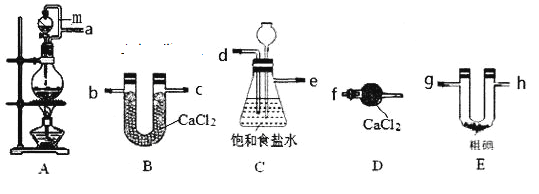
(1)按照气流方向连接接口顺序为a→__________________________________________。装置A中导管m的作用是____________________________________________。
(2)装置C用于除杂,同时作为安全瓶,能监测实验进行时后续装置是否发生堵塞,若发生堵塞C中的现象为____________________________________________________。
(3)氯气与单质碘需在温度稍低于70℃下反应,则装置E适宜的加热方式为____________。装置E中发生反应的化学方程式为_________________________________________。
(4)该装置存在的明显缺陷是_____________________________________。
(5)粗碘的制备流程为:

操作Y用到的玻璃仪器有烧杯、____________,操作Z的名称为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g) ⊿ H1= + 67.7kJ/mol;
N2H4(g)+O2(g)= N2(g)+2H2O(g) ⊿ H2= - 534kJ/mol;
2H2(g)+ O2(g)= 2H2O (g) ⊿ H3= - 484kJ/mol;
H2(g)+F2(g)=2HF(g) ⊿ H4= - 538kJ/mol
①写出N2H4与 NO2反应的热化学方程式______________________,
②写出N2H4与F2反应的热化学方程式__________________________
(2)已知反应:Cl2+2HBr===Br2+2HCl。
Ⅰ.当有0.2 mol HCl生成时放出8.1 kJ的热量。
Ⅱ.其能量变化示意图如图:

由上述数据判断断开1 mol H—Cl 键与断开 1 mol H—Br键所需能量相差约为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Na2SO4的相对分子质量为142,则500mL1.0mol·L-1Na2SO4溶液含有溶质质量为( )
A.35.5gB.71gC.119gD.142g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。E是具有果香气味的液体。A、B、C、D、E在一定条件下存在如图转化关系(部分反应条件、产物被省略)

请回答下列问题:
(1)工业上,由石油获得白蜡油的方法是___。
(2)丁烷是由石蜡油求得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基(﹣CH3),则这种同分异构体的结构简式是___。
(3)反应B→C反应发生需要的条件为___,D物质中官能团的名称是___。
(4)写出B+D→E的化学方程式___;该反应的速率比较缓慢,实验中为了提高该反应的速率,通常采取的措施有___(写出其中一条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B. ![]() 的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C. ![]() 的溶液:NH4+、Cu2+、NO3-、Cl-
的溶液:NH4+、Cu2+、NO3-、Cl-
D. 水电离的c(H+)=1×10﹣13 mol·L﹣1的溶液中:K+、Na+、AlO2﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带含有丰富的碘。为了从海带中提取碘,某学习小组设计并进行了以下实验:

(1)海带提碘实验中不需要的仪器是_________(选填编号)。
A.![]() B.
B.![]() C.
C.![]() D.
D. ![]()
(2)步骤③的实验操作名称是____________;用到的玻璃仪器有(写仪器名称)_____________________________________。
(3)步骤④反应的离子方程式是__________________________________。
(4)步骤⑤是用有机溶剂将碘从水中提取出来,此过程包含的实验操作是_______________、_______________。不能用酒精代替苯的理由是_________________________(用文字简述)。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法(用文字简述):_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系式错误的是( )
A. CO2的水溶液:c(H+)>c(HCO3-)>2c(CO32-)
B. 等浓度的HCN溶液与NaOH溶液等体积混合,所得溶液pH>7,则溶液中离子浓度:c(Na+)>c(CN-) >c(OH-)>c(H+)
C. NaHCO3溶液中存在水解平衡:HCO3-+H2OH2CO3+OH-
D. 两种弱酸HX和HY混合后,溶液中的c(H+)为(Ka为电离平衡常数) ![]() +
+![]() + c(OH-)
+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com