
【题目】已知Na2SO4的相对分子质量为142,则500mL1.0mol·L-1Na2SO4溶液含有溶质质量为( )
A.35.5gB.71gC.119gD.142g
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2等温室气体的排放所带来的温室效应已经对人类的生存环境产生很大影响。CO2的利用也成为人们研究的热点。以CO2和H2为原料合成甲醇技术获得应用。
(1)已知CH3OH (g)+![]() O2(g)===CO2(g)+2H2O(l ) △H1=-363 kJ/mol
O2(g)===CO2(g)+2H2O(l ) △H1=-363 kJ/mol
2H2(g)+O2(g)===2H2O(1) △H2=-571.6kJ/mol
H2O(1)====H2O(g) △H3=+44 kJ/ mol
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的反应热△H=___________。
CH3OH(g)+H2O(g)的反应热△H=___________。
(2)该反应常在230~280℃、1.5MPa条件下进行。采用催化剂主要组分为CuO-ZnO-Al2O3。催化剂活性组分为单质铜,因此反应前要通氢气还原。写出得到活性组分的反应的化学方程式:__________________________________________。使用不同催化剂时,该反应反应热△H__________(填“相同”或“不同”)
(3)该反应可以看作以下两个反应的叠加:
CO2(g)+H2(g)![]() CO(g)+H2O(g),平衡常数K1;
CO(g)+H2O(g),平衡常数K1;
CO(g)+2H2(g)![]() CH3OH(g),平衡常数K2;
CH3OH(g),平衡常数K2;
则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=___________(用含K1、K2的代数式表示)
CH3OH(g)+H2O(g)的平衡常数K=___________(用含K1、K2的代数式表示)
(4)反应过程中,发现尾气中总会含有一定浓度的CO,为了减少其浓度,可以采取的措施为_________________________________(写一条即可)
(5)为了提高反应速率,采取的措施可以有___________。
A.使用高效催化剂 B.在较高压强下进行 C.降低压强 D.充入高浓度CO2
(6)有人研究了用电化学方法把CO2转化为CH3OH,其原理如图所示:
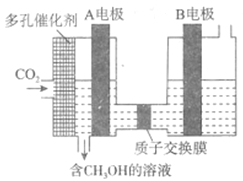
则图中A电极接电源___________极。已知B电极为惰性电极,则在水溶液中,该极的电极反应为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2HI(g)![]() H2(g) +I2(g)的能量变化如图所示。下列说法正确的是
H2(g) +I2(g)的能量变化如图所示。下列说法正确的是

A. 常温下,向体积为VL的容器中充入2mol HI(g)充分反应,可吸收12.5kJ的热量
B. 加入催化剂,分子的能量不变,但单位体积活化分子数增多,速率加快
C. 其他条件不变,升高温度,反应速率加快,HI分解率不变
D. H2(g) +I2(g)![]() 2HI(g)的活化能Ea为12.5kJ·mol1
2HI(g)的活化能Ea为12.5kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B. 容量瓶、量筒上都标有使用温度,都无“0”刻度,用量筒量取完液体后需洗涤残留在内壁上的液体并与刚量完的液体合并
C. 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
D. 用容量瓶配溶液时,若加水超过刻度线,立即倒掉重配
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:

(1)“O”点导电能力为0的理由是_________________________。
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为____________。
(3)a、b、c三点处,电离程度最大的是________。
(4)若将c点溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施是:
①____________________________________________________;
②___________________________________________________;
③___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:
①增加Fe的量,其反应速率____(填“增大”、“不变”或“减小”,下同)。
②将容器的体积缩小一半,其反应速率____。
③保持体积不变,充入He,其反应速率____。
④保持压强不变,充入He,其反应速率_____。
(2)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是____(填字母序号)
a.反应速率5v(NH3)=4v(N2)
b.单位时间里每生成5mol N2,同时生成4mol NH3
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为_____(选填字母)。

(3)298K时,若已知生成标准状况下2.24LNH3时放出热量为4.62kJ。写出合成氨反应的热化学方程式____。
(4)一定条件下,在2L密闭容器内,反应2NO2(g)=N2O4(g)△H=-180kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均速度____。在第5s时,NO2的转化率为____。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AOH为弱碱,已知:2AOH(aq)+H2SO4(aq)===A2SO4(aq)+2H2O(l) ΔH1=-24.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则AOH在水溶液中电离的ΔH为( )
A. +33.1 kJ·mol-1 B. +45.2 kJ·mol-1 C. -81.5 kJ·mol-1 D. -33.1 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com