
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A. 使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B. ![]() 的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
C. ![]() 的溶液:NH4+、Cu2+、NO3-、Cl-
的溶液:NH4+、Cu2+、NO3-、Cl-
D. 水电离的c(H+)=1×10﹣13 mol·L﹣1的溶液中:K+、Na+、AlO2﹣、CO32﹣
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用下图可以从不同角度研究含氮物质的性质及其转化关系。图中甲~辛均含氮元素。回答下列问题:
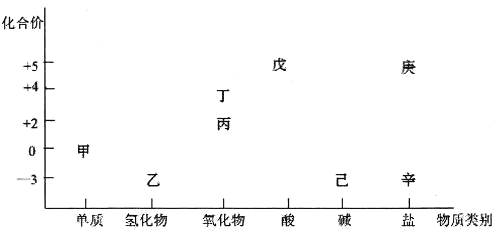
(1)下列给出的图中物质之间的转化可以一步实现的是__________。
A.甲→丁 B.乙→丁 C.丁→戊 D.戊→丙
(2)下列说法正确的是____________。
A.丙和丁在一定条件下都能生成戊,属于酸性氧化物
B.“甲→乙→丙→丁→戊”就是工业制戊的转化过程
C.己和辛在一定条件下都可与固体NaOH作用生成乙,其生成乙的原理相同
D.如果庚和辛为同种物质,则可由乙和戊反应制得
(3)氯碱工业生产中常用乙检查氯气管道是否泄漏,其现象为______________________。已知反应过程中还有甲生成,该反应的化学方程式为______________________________。
(4)已知铁与过量戊的溶液反应,其反应的化学方程式为:Fe+戊→丙+丁+庚+H2O(方程式未配平)。若产物中丙和丁的物质的量之比为1:3,则铁与戊的物质的量之比为_________。若检验庚中铁元素的价态,可选用的试剂为_________,反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2HI(g)![]() H2(g) +I2(g)的能量变化如图所示。下列说法正确的是
H2(g) +I2(g)的能量变化如图所示。下列说法正确的是

A. 常温下,向体积为VL的容器中充入2mol HI(g)充分反应,可吸收12.5kJ的热量
B. 加入催化剂,分子的能量不变,但单位体积活化分子数增多,速率加快
C. 其他条件不变,升高温度,反应速率加快,HI分解率不变
D. H2(g) +I2(g)![]() 2HI(g)的活化能Ea为12.5kJ·mol1
2HI(g)的活化能Ea为12.5kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B. 容量瓶、量筒上都标有使用温度,都无“0”刻度,用量筒量取完液体后需洗涤残留在内壁上的液体并与刚量完的液体合并
C. 金属汞一旦洒落在实验室地面或桌面时,必须尽可能收集,并深埋处理
D. 用容量瓶配溶液时,若加水超过刻度线,立即倒掉重配
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示。请回答:

(1)“O”点导电能力为0的理由是_________________________。
(2)a、b、c三点处,溶液的c(H+)由小到大的顺序为____________。
(3)a、b、c三点处,电离程度最大的是________。
(4)若将c点溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施是:
①____________________________________________________;
②___________________________________________________;
③___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述不正确的是
A.适当地摄入一定量的油脂,能促进脂溶性维生素的吸收
B.淀粉水解的最终产物是葡萄糖
C.葡萄糖在人体内发生氧化反应能放出大量热量
D.淀粉、纤维素、油脂、蛋白质都是高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,试回答:
①增加Fe的量,其反应速率____(填“增大”、“不变”或“减小”,下同)。
②将容器的体积缩小一半,其反应速率____。
③保持体积不变,充入He,其反应速率____。
④保持压强不变,充入He,其反应速率_____。
(2)氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
①能说明该反应已达到平衡状态的标志是____(填字母序号)
a.反应速率5v(NH3)=4v(N2)
b.单位时间里每生成5mol N2,同时生成4mol NH3
c.容器内N2的物质的量分数不再随时间而发生变化
d.容器内n(NO):n(NH3):n(N2):n(H2O)=6:4:5:6
②某次实验中测得容器内NO及N2的物质的量随时间变化如图所示,图中v(正)与v(逆)相等的点为_____(选填字母)。

(3)298K时,若已知生成标准状况下2.24LNH3时放出热量为4.62kJ。写出合成氨反应的热化学方程式____。
(4)一定条件下,在2L密闭容器内,反应2NO2(g)=N2O4(g)△H=-180kJ·mol-1,n(NO2)随时间变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均速度____。在第5s时,NO2的转化率为____。根据上表可以看出,随着反应进行,反应速率逐渐减小,其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)可用作催化剂、杀菌剂、媒染剂、脱色剂。CuCl是一种白色粉末,微溶于水、不溶于乙醇,在潮湿的空气中易被氧化。实验室采用如图装置和下列步骤制备氯化亚铜。
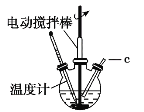
步骤1:在三颈烧瓶中加入20%盐酸、食盐、铜屑,加热至60~70℃,开动搅拌器,同时从c口缓慢通入氧气,制得Na[CuCl2]溶液。
步骤2:反应完全后,冷却,过滤,滤液用适量的水稀释,析出CuCl。
步骤3:过滤,分别用盐酸、乙醇洗涤滤出的固体。
步骤4:在真空干燥器中60~70 ℃干燥2h,冷却后得到产品。
回答下列问题:
(1)质量分数为20%的盐酸密度为1.1g/cm3,物质的量浓度为___________;配制20%盐酸需要的玻璃仪器有:__________、烧杯、玻璃棒、胶头滴管。
(2)步骤1中制得Na[CuCl2]的化学方程式为________________________________。
(3)根据“步骤2中用水稀释滤液能得到CuCl”推测,滤液中存在的平衡是____________。
(4)析出的CuCl晶体不用水而用盐酸、乙醇分别洗涤的目的是__________________。
(5)测定产品中氯化亚铜的质量分数,实验过程如下:
准确称取制备的氯化亚铜产品0.25 g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.10 mol/L的硫酸铈[Ce(SO4)2]标准溶液滴定到终点,消耗硫酸铈溶液24.50 mL,反应中Ce4+被还原为Ce3+。(已知:CuCl+FeCl3=CuCl2+FeCl2)
①硫酸铈标准溶液应盛放在________(填“酸”或“碱”)式滴定管中。
②产品中氯化亚铜的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2 L的固定密闭容器中通入2mol X气体,在一定温度下发生如下反应:2X(g) ![]() Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。
Y(g)+3Z(g)ΔH=+92.0kJ· mol-1。经5 min 后反应达到平衡,此时测得容器内的压强为起始时的1.5倍。
(1)用Y表示的化学反应速率为_____,X的转化率为______,平衡时反应吸收的热量为_________。
(2)在定温,定容的条件下向平衡体系中再充入1mol X(g)气体,平衡______(填“正向”“不”“逆向”)移动, X(g)的转化率______(填“增大”“减小”“不变”),Y(g)的质量分数______(填“增大”“减小”“不变”)。
(3)在相同温度,相同容积的密闭容器中起始时充入0.8molX(g),0.6molY(g),1.8molZ(g),此时V正______V逆(填“大于”、“小于”或“等于”);平衡时X(g)的百分含量______ (填“大于”、“小于”或“等于”)原平衡。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com