
����Ŀ��������ͼ���ԴӲ�ͬ�Ƕ��о��������ʵ����ʼ���ת����ϵ��ͼ�мס���������Ԫ�ء��ش��������⣺
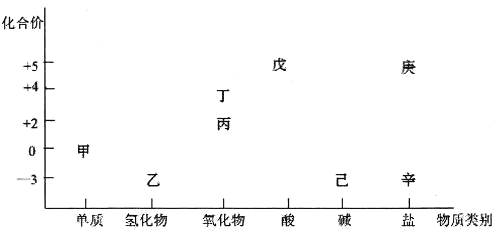
(1)���и�����ͼ������֮���ת������һ��ʵ�ֵ���__________��
A���ס��� B���ҡ��� C�������� D�������
(2)����˵����ȷ����____________��
A�����Ͷ���һ�������¶��������죬��������������
B�����ס��ҡ����������족���ǹ�ҵ�����ת������
C����������һ�������¶��������NaOH���������ң��������ҵ�ԭ����ͬ
D�����������Ϊͬ�����ʣ�������Һ��췴Ӧ�Ƶ�
(3)�ȼҵ�����г����Ҽ�������ܵ��Ƿ�й©��������Ϊ______________________����֪��Ӧ�����л��м����ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
(4)��֪������������Һ��Ӧ���䷴Ӧ�Ļ�ѧ����ʽΪ��Fe+�����+��+��+H2O(����ʽδ��ƽ)���������б��Ͷ������ʵ���֮��Ϊ1��3��������������ʵ���֮��Ϊ_________�������������Ԫ�صļ�̬����ѡ�õ��Լ�Ϊ_________����Ӧ�����ӷ���ʽΪ___________��
���𰸡�CD BD �а������� 3Cl2+8NH3=N2+6NH4Cl 1��5 KSCN��Һ Fe3++3SCN-=Fe(SCN)3
��������
����NԪ�صĻ��ϼۼ���������������֪����N2������NH3������NO������NO2������HNO3������NH3H2O����Ϊ�����Ρ���Ϊ��Σ�Ȼ���������ʵ����ʷ������
����ͼʾ��NԪ�صĻ��ϼۼ�����������������֪����N2������NH3������NO������NO2������HNO3������NH3H2O����Ϊ�����Ρ���Ϊ��Ρ�
(1)A.������Ӧ��N2+O2 ![]() 2NO�����ܲ���NO2��A����
2NO�����ܲ���NO2��A����
B.4NH3+5O2![]() 4NO+6H2O�����ܲ���NO2��B����
4NO+6H2O�����ܲ���NO2��B����
C.3NO2+H2O=2HNO3+NO��C��ȷ��
D.3Cu��8HNO3(ϡ)=2Cu(NO3)2��2NO����4H2O��D��ȷ��
�ʺ���ѡ����CD��
(2)A.NO��NO2��һ�������¿��Է�����Ӧ����HNO3������Ӧ������NԪ�صĻ��ϼ۷����˱仯������NO��NO2���������������A����
B.�ڹ�ҵ�������ð��Ĵ�����������ȡ���ᣬ�����ķ�ӦΪ��N2+3H2 ![]() 2NH3��4NH3+5O2
2NH3��4NH3+5O2![]() 4NO+6H2O��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO���ɼ��ڷ�Ӧ������ʵ���˼������������������ת����B��ȷ��
4NO+6H2O��2NO+O2=2NO2��3NO2+H2O=2HNO3+NO���ɼ��ڷ�Ӧ������ʵ���˼������������������ת����B��ȷ��
C.NH3H2O����Һ�д��ڵ���ƽ����NH3H2O![]() NH4++OH-��������Һ�м���NaOH����ʱ��c(OH-)����ƽ�������ƶ���NH3H2OŨ������NH3H2O�����ֽⷴӦ����������ͬʱNaOH�ܽ����Ҳ�ٽ���NH3H2O�ķֽ⣻�������NaOH�����ϼ��ȷ������Ǹ��ֽⷴӦ������������˶�����ȡ������ԭ����ͬ��C����
NH4++OH-��������Һ�м���NaOH����ʱ��c(OH-)����ƽ�������ƶ���NH3H2OŨ������NH3H2O�����ֽⷴӦ����������ͬʱNaOH�ܽ����Ҳ�ٽ���NH3H2O�ķֽ⣻�������NaOH�����ϼ��ȷ������Ǹ��ֽⷴӦ������������˶�����ȡ������ԭ����ͬ��C����
D.��Ϊ�����Σ���Ϊ��Σ�������Ϊͬһ�����ʣ����������NH4NO3������ͨ����ӦNH3+ HNO3=NH4NO3�õ���D��ȷ��
�ʺ���ѡ����BD��
(3)�ȼҵ�����г����Ҽ�������ܵ�������Ϊ������Ӧ��3Cl2+8NH3=N2+6NH4Cl��NH4Cl�ǰ�ɫ���壬����������ܵ�й©���ῴ���а��̲�����
(4)�������⼰��Ӧ������NO��NO2�����ʵ����ıȣ���ϵ����غ㡢ԭ���غ㣬�ɵ÷�Ӧ�Ļ�ѧ����ʽΪ��2Fe+10HNO3=2Fe(NO3)3+NO��+3NO2��+5H2O�����ݷ���ʽ��֪Fe��HNO3��Ӧ�����ʵ����ı�Ϊ1��5����Ӧ������Fe3+��������KSCN��Һ���顣����������Һ�еμӼ���KSCN��Һ����������Һ��ΪѪ��ɫ����֤������Fe3+����Ӧ�����ӷ���ʽΪFe3++3SCN-=Fe(SCN)3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��Na2O2�ĵ���ʽ____________________
��2��д��������Ԫ������Ԫ�ط���__________,��Ԫ�ص��ʵı���Һ��ɫΪ______________��
��3��д��ľ̿��Ũ���Ṳ��ʱ�����Ļ�ѧ��Ӧ����ʽ��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�ص�ԭ�Ӻ�������Ų��У�������������ϵĵ�������ȵ���
A. �� B. � C. þ D. ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֶ�����Ԫ�������ڱ��е�λ������ͼ������ֻ��ZΪ����Ԫ�ء�����˵������ȷ���ǣ� ��
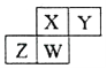
A. ԭ�Ӱ뾶W��Y
B. X�������̬�⻯������ȶ��Ա�W��С
C. ZԪ�ص������������ǿ�ᷴӦ������ǿ�Ӧ
D. Y���⻯����������ۺ����ᷴӦ�������ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ���(IC13)��ҩ��ϳ�����;�dz��㷺����֪ICl3�۵�33�棬�е�73�棬����ʪ�ԣ���ˮ��ˮ�⡣ijС��ͬѧ������װ����ȡICl3(���ּгֺͼ���װ��ʡ��)��
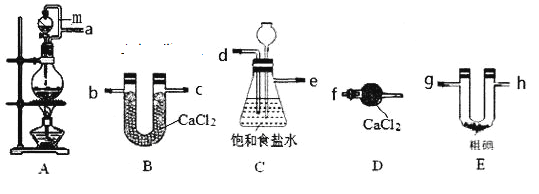
(1)���������������ӽӿ�˳��Ϊa��__________________________________________��װ��A�е���m��������____________________________________________��
(2)װ��C���ڳ��ӣ�ͬʱ��Ϊ��ȫƿ���ܼ��ʵ�����ʱ����װ���Ƿ�������������������C�е�����Ϊ____________________________________________________��
(3)�����뵥�ʵ������¶��Ե���70���·�Ӧ����װ��E���˵ļ��ȷ�ʽΪ____________��װ��E�з�����Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
(4)��װ�ô��ڵ�����ȱ����_____________________________________��
(5)�ֵ���Ʊ�����Ϊ��

����Y�õ��IJ����������ձ���____________������Z������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������д������·�Ӧ��2SO2��g��+O2��g��![]() 2SO3��g����H��0��ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ�������
2SO3��g����H��0��ij�о�С���о���������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ�������

A. ͼ���ʾ����t1ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
B. ͼ���ʾ����t1ʱ�̼��������Է�Ӧ���ʵ�Ӱ��
C. ͼ���ʾ���Ǵ�����ƽ���Ӱ�죬�ҼĴ�Ч�ʱ��Ҹ�
D. ͼ���ʾ����ѹǿ�Ի�ѧƽ���Ӱ�죬���ҵ�ѹǿ�ϸ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ�������(PFS)��һ�ָ�Чˮ���������㷺Ӧ���ڹ�ҵ��ˮ��������ˮ����ҵ��ˮ����������ˮ�ȵľ�����������һ�ֺϳɷ����������£�
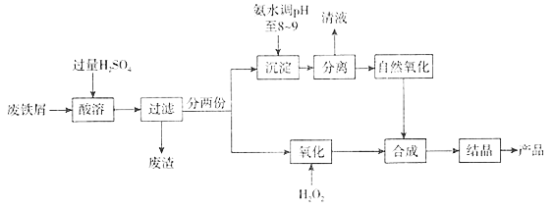
�ش���������
��1���ۺ�����������ʽ�ɱ�ʾΪ[Fe2(OH)n(SO4)x]m������Fe���ϼ�Ϊ+3����x=___________(�ú�n�Ĵ���ʽ��ʾ)��
��2�������ͨ��ʹ����ᆳ���ú���ȥ�ϲ���Һ���ɡ���Һ����������Ҫ������___________��
��3������Ȼ�����Σ�������õ�����״�����ᱻ�����������ý���ɵı�־�dz�����ɫ��Ϊ___________��������Ӧ�Ļ�ѧ����ʽΪ______________________��Ϊ��ʹ��Ӧ��֣������Բ�ȡ�Ĵ�ʩ��______________________(дһ������)��
��4���������Σ���������Ҫ��Ӧ�����ӷ���ʽΪ_________________________________����ӦҪ������ڽ����»�������˫��ˮ��������Ϊ�÷�Ӧ���ȣ���Ӧ���ң�Ϊ��ֹΣ���⣬����Ϊ_________________________________��
��5��Ϊ�˼������ò�Ʒ���Ƿ���Fe2+ (����������ԭ������)��ȡ������Ʒ��ȫ����ˮ������ˮϡ�ͣ���ʱ��Һ������ɫ��Ȼ����0.01mol/L�����Ը�����ر���Һ�ζ�����ζ����յ�ʱ��ʵ��������_______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
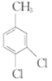
����Ŀ�����ǰ�����(�ṹʽΪ ����ѧʽΪC13H10ClF3N2O6S)Ϊ��Ч����ѿ����ݼ������Ӳ�������ʩҩ����Ч����һ������Ҷ�Ӳݡ���ϳɷ�����ͼ��
����ѧʽΪC13H10ClF3N2O6S)Ϊ��Ч����ѿ����ݼ������Ӳ�������ʩҩ����Ч����һ������Ҷ�Ӳݡ���ϳɷ�����ͼ��
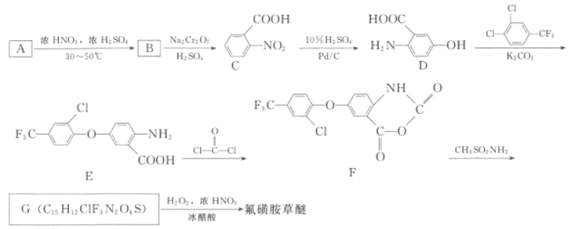
�ش��������⣺
��1����֪A�ķ���ʽΪC7H8������ṹ��ʽΪ_______________��
��2��д����A��B��Ӧ�Ļ�ѧ����ʽ��______________________����B������ͬ�����ŵ�B��ͬ���칹����___________�������к˴Ź����������շ������ֵΪ2��2��2��1����___________(д�ṹ��ʽ)
��3��������Ӧ�У�B��C����___________��Ӧ��E��F����___________��Ӧ��
��4��G�Ľṹ��ʽΪ___________��
��5�����������Ϣ��д���� ��
�� Ϊԭ�Ϻϳ�
Ϊԭ�Ϻϳ�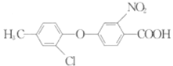 ������ͼ(�������Լ���ѡ)��_________________
������ͼ(�������Լ���ѡ)��_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ������ָ����Һ�д����������( )
A. ʹ��̪���ɫ����Һ�У�Na+��Al3+��SO42����Cl��
B. ![]() ����Һ�У�NH4+��Ca2+��Cl����NO3��
����Һ�У�NH4+��Ca2+��Cl����NO3��
C. ![]() ����Һ��NH4+��Cu2+��NO3����Cl��
����Һ��NH4+��Cu2+��NO3����Cl��
D. ˮ�����c(H+)=1��10��13 mol��L��1����Һ�У�K+��Na+��AlO2����CO32��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com