
����Ŀ�����Ȼ���(IC13)��ҩ��ϳ�����;�dz��㷺����֪ICl3�۵�33�棬�е�73�棬����ʪ�ԣ���ˮ��ˮ�⡣ijС��ͬѧ������װ����ȡICl3(���ּгֺͼ���װ��ʡ��)��
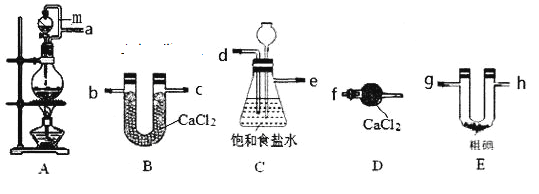
(1)���������������ӽӿ�˳��Ϊa��__________________________________________��װ��A�е���m��������____________________________________________��
(2)װ��C���ڳ��ӣ�ͬʱ��Ϊ��ȫƿ���ܼ��ʵ�����ʱ����װ���Ƿ�������������������C�е�����Ϊ____________________________________________________��
(3)�����뵥�ʵ������¶��Ե���70���·�Ӧ����װ��E���˵ļ��ȷ�ʽΪ____________��װ��E�з�����Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
(4)��װ�ô��ڵ�����ȱ����_____________________________________��
(5)�ֵ���Ʊ�����Ϊ��

����Y�õ��IJ����������ձ���____________������Z������Ϊ__________��
���𰸡�a��d��e��b��c��g��h��f�����ӿ�b��c��g��h�ɻ����� ʹŨ����˳������ ��ƿ��Һ���½�������©����Һ������ ˮԡ���� 3Cl2+I2 ![]() 2ICl3 ȱ��β������װ�� ��Һ©�� ����
2ICl3 ȱ��β������װ�� ��Һ©�� ����
��������
(1)װ������˳��Ϊ��ȡ����װ�á���������װ�á���������װ�á�������Ӧװ�á���ֹ����װ�ã�
(2)װ��C����ȫƿ�����ʵ�����ʱB���Ƿ���������B��������ʱ��C��ѹǿ��������ѹǿ��Һ�����÷���ʵ������
(3)ˮԡ���¶Ȳ�����100������ˮԡ�����ܼ����Ƽ����¶ȣ�ʹ�����������Ⱦ��ȣ�������֪���ʡ��Ʊ����ʣ���Ϸ�Ӧ������������Ӧ��Ӧ������д��Ӧ����ʽ��
(4)�������ж������壬Ҫ��β������װ�ã�
(5)����Y����ȡ��ʹ�÷�Һ©�����ձ�������Z������
(1)��װ��A����Ũ������MnO2��ϼ�����ȡCl2��Ũ�����ӷ���ʹ��Ӧ��ȡ�������к����Ȼ��⡢ˮ���������ʣ�ͨ��װ��C��ȥHCl���ʣ���ͨ��װ��B����õ����������������Ȼ����װ��E��������ⵥ�ʷ�Ӧ�Ƶ�ICl3��Ϊ��ֹICl3���⣬��������ʢ�и������Dװ�ã���ֹ�����е�ˮ�������뵽��ȡEװ�����ʰ���������������װ�ýӿ�˳��Ϊa��d��e��b��c��g��h��f�����ӿ�b��c��g��h�ɻ���������װ��A�е���mʹ��Һ©���е�Һ������ѹǿһ�£�������Һ©���е�Ũ����Ϳ���˳�����£�
(2)װ��C���ǰ�ȫƿ�����ʵ�����ʱB���Ƿ�����������װ��B����������C������ѹǿ����Һ�����뵽����©���У�ʹ��ƿ��Һ���½�������©����Һ��������
(3)��ˮԡ�����ܼ����Ƽ��ȵ��¶ȣ�����ʹ��Ӧ�Թ����Ⱦ��ȣ����������뵥�ʵ������¶��Ե���70���·�Ӧ����Ӧ��ȡˮԡ���ȵķ�ʽ����װ��E��Cl2��I2�ڵ���70���¶��·�����Ӧ��3Cl2+I2 ![]() 2ICl3��
2ICl3��
(4)Cl2���ж����壬ʢ����ˮ�Ȼ��Ƶĸ����ֻ������ˮ�֣��������������������ͻ���ɴ�����Ⱦ��������ˮCaCl2���ɼ�ʯ�ң��Ϳ�������������ˮ�����������˴�����Ⱦ���ʸ�װ�õ�ȱ����ȱ��β������װ�ã�
(5)����Y�Ǽ���CCl4������I2�ӵ�ˮ����ȡ������������õ��IJ����������ձ��ͷ�Һ©�������������Ȼ�̼��Һ���������ܼ����Ը��ݶ��߷е㲻ͬ��������ķ����������ǡ�


 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mL FeI2��Һ����ͨ��C12,����n(I2)��n(Fe3+)��ͨ��n(C12)�ı仯��ͼ��ʾ,����˵������ȷ����

A. ������ǿ��:I2<Fe3+
B. n(Cl2)=0.12molʱ,��Һ�е�������Ҫ��Fe2+��Fe3+��Cl��
C. ��ͼ��֪,��FeI2��Һ��Ũ��Ϊ1mol�� L-l
D. n(C12):n(FeI2)=1:2ʱ,��Ӧ�����ӷ���ʽΪ:2Fe2++Cl2=2Fe3++2Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ԭ�����͵���
A. ʹ������ý���ӿ�ϳɰ���Ӧ���� B. ʵ�������ű���ʳ��ˮ���ռ�����
C. ����ˮƿ�ǣ����д�������ݳ� D. �¶����ߣ���ˮ�е�H+Ũ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��I2��һ���������ܷ�����Ӧ��H2(g) + I2(g)![]() 2HI(g) ��H����a kJ��mol��1
2HI(g) ��H����a kJ��mol��1
��֪�� (a��b��c��������)
(a��b��c��������)
����˵������ȷ����( )
A. ��Ӧ��������������������������
B. �Ͽ�1 mol H��H����1 mol I��I�������������ڶϿ�2 mol H��I����������
C. �Ͽ�2 mol H��I����������ԼΪ(c+b+a) kJ
D. ���ܱ������м���2 mol H2��2 mol I2����ַ�Ӧ��ų�������С��2a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I2��KI��Һ�д�������ƽ�⣺I2(aq)+I-(aq) ![]() I3-(aq)��H��ijI2��KI�����Һ�У�I-�����ʵ���Ũ��c(I-)���¶�T�Ĺ�ϵ��ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������˵������ȷ����
I3-(aq)��H��ijI2��KI�����Һ�У�I-�����ʵ���Ũ��c(I-)���¶�T�Ĺ�ϵ��ͼ��ʾ(�������κ�һ�㶼��ʾƽ��״̬)������˵������ȷ����
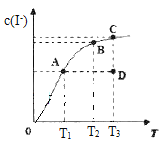
A. �÷�Ӧ��H<0
B. ����T1��T2�¶��£���Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2����K1>K2
C. ����Ӧ���е�״̬Dʱ��һ����v��>v��
D. ״̬A��״̬B��ȣ�״̬A��c(I3-)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ���ԴӲ�ͬ�Ƕ��о��������ʵ����ʼ���ת����ϵ��ͼ�мס���������Ԫ�ء��ش��������⣺
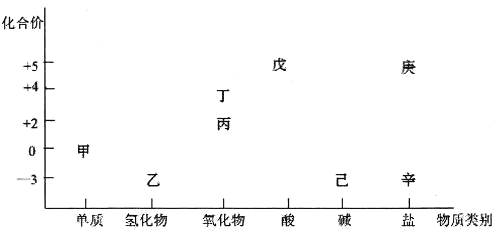
(1)���и�����ͼ������֮���ת������һ��ʵ�ֵ���__________��
A���ס��� B���ҡ��� C�������� D�������
(2)����˵����ȷ����____________��
A�����Ͷ���һ�������¶��������죬��������������
B�����ס��ҡ����������족���ǹ�ҵ�����ת������
C����������һ�������¶��������NaOH���������ң��������ҵ�ԭ����ͬ
D�����������Ϊͬ�����ʣ�������Һ��췴Ӧ�Ƶ�
(3)�ȼҵ�����г����Ҽ�������ܵ��Ƿ�й©��������Ϊ______________________����֪��Ӧ�����л��м����ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ______________________________��
(4)��֪������������Һ��Ӧ���䷴Ӧ�Ļ�ѧ����ʽΪ��Fe+�����+��+��+H2O(����ʽδ��ƽ)���������б��Ͷ������ʵ���֮��Ϊ1��3��������������ʵ���֮��Ϊ_________�������������Ԫ�صļ�̬����ѡ�õ��Լ�Ϊ_________����Ӧ�����ӷ���ʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ 0.783g MnO2 �м��� 20mL36.5%����=1.18g/cm3 ��Ũ���������ȡ Cl2����Ӧ����ʽΪ��MnO2+4HClMnCl2+Cl2+2H2O������Ӧ����Һ�����Ϊ 20mL��������˵����ȷ���ǣ�������
A.��Ӧ���� HCl ���ʵ���Ϊ 0.236mol
B.��Ӧ���� Cl2 ��������Ϊ 201.6mL
C.��ȡ 2mL ��Ӧ�����Һ���������� AgNO3���ɲ������� 2.87g
D.��ȡ 2mL ��Ӧ�����Һ������ 2.0mol/L �� NaOH���������ﵽ���ֵʱ������ NaOH ��Һ�����Ϊ10.9mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2������������ŷ�������������ЧӦ�Ѿ�����������滷�������ܴ�Ӱ�졣CO2������Ҳ��Ϊ�����о����ȵ㡣��CO2��H2Ϊԭ�Ϻϳɼ״��������Ӧ�á�
��1����֪CH3OH (g)+![]() O2(g)===CO2(g)+2H2O(l ) ��H1=��363 kJ/mol
O2(g)===CO2(g)+2H2O(l ) ��H1=��363 kJ/mol
2H2(g)+O2(g)===2H2O(1) ��H2=��571.6kJ/mol
H2O(1)====H2O(g) ��H3=+44 kJ/ mol
��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)�ķ�Ӧ����H=___________��
CH3OH(g)+H2O(g)�ķ�Ӧ����H=___________��
��2���÷�Ӧ����230~280�桢1.5MPa�����½��С����ô�����Ҫ���ΪCuO-ZnO-Al2O3�������������Ϊ����ͭ����˷�ӦǰҪͨ������ԭ��д���õ�������ֵķ�Ӧ�Ļ�ѧ����ʽ��__________________________________________��ʹ�ò�ͬ����ʱ���÷�Ӧ��Ӧ����H__________(������ͬ��������ͬ��)
��3���÷�Ӧ���Կ�������������Ӧ�ĵ��ӣ�
CO2(g)+H2(g)![]() CO(g)+H2O(g)��ƽ�ⳣ��K1��
CO(g)+H2O(g)��ƽ�ⳣ��K1��
CO(g)+2H2(g)![]() CH3OH(g)��ƽ�ⳣ��K2��
CH3OH(g)��ƽ�ⳣ��K2��
��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��ƽ�ⳣ��K=___________(�ú�K1��K2�Ĵ���ʽ��ʾ)
CH3OH(g)+H2O(g)��ƽ�ⳣ��K=___________(�ú�K1��K2�Ĵ���ʽ��ʾ)
��4����Ӧ�����У�����β�����ܻẬ��һ��Ũ�ȵ�CO��Ϊ�˼�����Ũ�ȣ����Բ�ȡ�Ĵ�ʩΪ_________________________________(дһ������)
��5��Ϊ����߷�Ӧ���ʣ���ȡ�Ĵ�ʩ������___________��
A.ʹ�ø�Ч���� B.�ڽϸ�ѹǿ�½��� C.����ѹǿ D.�����Ũ��CO2
��6�������о����õ绯ѧ������CO2ת��ΪCH3OH����ԭ����ͼ��ʾ��
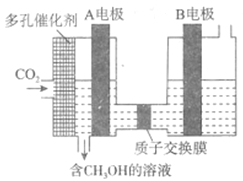
��ͼ��A�缫�ӵ�Դ___________������֪B�缫Ϊ���Ե缫������ˮ��Һ�У��ü��ĵ缫��ӦΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£��������ˮϡ�����У���Һ�ĵ�������I�����ˮ�����V�仯��������ͼ��ʾ����ش�

��1����O���㵼������Ϊ0��������_________________________��
��2��a��b��c���㴦����Һ��c(H��)��С�����˳��Ϊ____________��
��3��a��b��c���㴦������̶�������________��
��4������c����Һ��c(CH3COO��)����c(H��)��С���ɲ�ȡ�Ĵ�ʩ��:
��____________________________________________________��
��___________________________________________________��
��___________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com