
【题目】实验室向 0.783g MnO2 中加入 20mL36.5%(ρ=1.18g/cm3 )浓盐酸后,共热制取 Cl2.反应方程式为:MnO2+4HClMnCl2+Cl2+2H2O,若反应后溶液体积仍为 20mL,则下列说法正确的是( )
A.反应消耗 HCl 物质的量为 0.236mol
B.反应生成 Cl2 气体的体积为 201.6mL
C.若取 2mL 反应后的溶液,加入足量 AgNO3,可产生沉淀 2.87g
D.若取 2mL 反应后的溶液,加入 2.0mol/L 的 NaOH,当沉淀达到最大值时,消耗 NaOH 溶液的体积为10.9mL
【答案】D
【解析】
盐酸的物质的量浓度c=![]() =(1000×1.18×36.5%/36.5 )molL-1=11.8mol/L,20mL36.5%(ρ=1.18g/cm3)浓盐酸中含有HCl的物质的量为11.8mol/L×0.02mol=0.236mol,0.783gMnO2的物质的量为
=(1000×1.18×36.5%/36.5 )molL-1=11.8mol/L,20mL36.5%(ρ=1.18g/cm3)浓盐酸中含有HCl的物质的量为11.8mol/L×0.02mol=0.236mol,0.783gMnO2的物质的量为![]() =0.009mol,二氧化锰与足量的浓盐酸反应MnO2+4HClMnCl2+Cl2+2H2O,在反应中MnO2完全溶解,盐酸不全部被氧化,部分表现为酸性,当盐酸浓度变稀后,MnO2不溶于稀盐酸,反应会停止,结合反应的化学方程式计算。
=0.009mol,二氧化锰与足量的浓盐酸反应MnO2+4HClMnCl2+Cl2+2H2O,在反应中MnO2完全溶解,盐酸不全部被氧化,部分表现为酸性,当盐酸浓度变稀后,MnO2不溶于稀盐酸,反应会停止,结合反应的化学方程式计算。
A.0.783gMnO2的物质的量为![]() =0.009mol,根据反应方程式MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,反应消耗 HCl 物质的量为0.009mol×4=0.036mol,故A错误;
=0.009mol,根据反应方程式MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,反应消耗 HCl 物质的量为0.009mol×4=0.036mol,故A错误;
B.反应中生成Cl2 气体的体积在标准状况下为0.009mol×22.4L/mol=0.2016L=201.6mL,故B错误;
C.根据原子守恒,反应后溶液中含有Cl﹣的物质的量为0.236mol﹣0.009mol×2=0.218mol,则取 2mL 反应后的溶液,加入足量 AgNO3,可产生AgCl沉淀质量为![]() ×143.5g/mol=3.1283g,故C错误;
×143.5g/mol=3.1283g,故C错误;
D.取 2mL 反应后的溶液,加入 2.0mol/L 的 NaOH,当沉淀达到最大值时,溶液中溶质为NaCl,则消耗 NaOH 溶液的体积为![]() /2.0molL-1 =0.0109L=10.9mL,故D正确;
/2.0molL-1 =0.0109L=10.9mL,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】在带有活塞的密闭容器中发生反应: Fe2O3+3H2==2Fe+3H2O,采取下列措施不能改变反应速率的是( )
A.增加Fe2O3的量
B.保持容器体积不变,增加H2输入量
C.充入N2,保持容器内压强不变
D.充入N2,保持容器内体积不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化碘(IC13)在药物合成中用途非常广泛。已知ICl3熔点33℃,沸点73℃,有吸湿性,遇水易水解。某小组同学用下列装置制取ICl3(部分夹持和加热装置省略)。
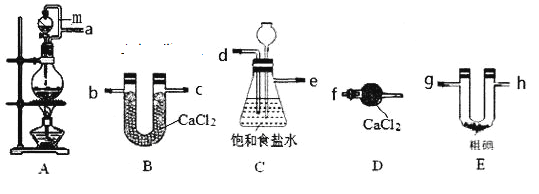
(1)按照气流方向连接接口顺序为a→__________________________________________。装置A中导管m的作用是____________________________________________。
(2)装置C用于除杂,同时作为安全瓶,能监测实验进行时后续装置是否发生堵塞,若发生堵塞C中的现象为____________________________________________________。
(3)氯气与单质碘需在温度稍低于70℃下反应,则装置E适宜的加热方式为____________。装置E中发生反应的化学方程式为_________________________________________。
(4)该装置存在的明显缺陷是_____________________________________。
(5)粗碘的制备流程为:

操作Y用到的玻璃仪器有烧杯、____________,操作Z的名称为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是一种高效水处理剂,广泛应用于工业废水、城市污水、工业用水及生活饮用水等的净化处理。其一种合成方法流程如下:
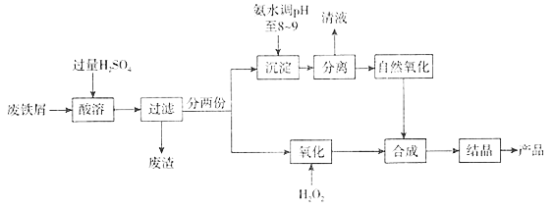
回答下列问题
(1)聚合硫酸铁分子式可表示为[Fe2(OH)n(SO4)x]m,其中Fe化合价为+3,则x=___________(用含n的代数式表示)。
(2)分离阶段通常使混合物经静置后倾去上层清液即可。清液中所含的主要离子是___________。
(3)在自然氧化阶段,经分离得到的絮状沉淀会被空气氧化。该阶段完成的标志是沉淀颜色变为___________。发生反应的化学方程式为______________________,为了使反应充分,还可以采取的措施有______________________(写一条即可)。
(4)在氧化阶段,发生的主要反应的离子方程式为_________________________________。反应要求必须在搅拌下缓缓加入双氧水,除了因为该反应放热,反应剧烈,为防止危险外,还因为_________________________________。
(5)为了检验所得产品中是否含有Fe2+ (不含其他还原性物质),取少量样品完全溶于水,并加水稀释,此时溶液几乎无色。然后用0.01mol/L的酸性高锰酸钾标准溶液滴定。则滴定至终点时的实验现象是_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,圆底烧瓶中盛有 0.18g 镁条,加入 10.00mL2.00mol/L 的硫酸溶液 反应完全后,产生氢气 180mL。
(1)根据实验数据计算,气体的摩尔体积为_____。
(2)反应过程中,装置内空气没有排除,空气的体积对实验结果____(填“有”或“无”)影响,请简述理由:________
(3)有同学认为:若镁条中混有杂质,则实验结果会偏低。请列举实例分析该同学的观点是否正确?____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g) ⊿ H1= + 67.7kJ/mol;
N2H4(g)+O2(g)= N2(g)+2H2O(g) ⊿ H2= - 534kJ/mol;
2H2(g)+ O2(g)= 2H2O (g) ⊿ H3= - 484kJ/mol;
H2(g)+F2(g)=2HF(g) ⊿ H4= - 538kJ/mol
①写出N2H4与 NO2反应的热化学方程式______________________,
②写出N2H4与F2反应的热化学方程式__________________________
(2)已知反应:Cl2+2HBr===Br2+2HCl。
Ⅰ.当有0.2 mol HCl生成时放出8.1 kJ的热量。
Ⅱ.其能量变化示意图如图:

由上述数据判断断开1 mol H—Cl 键与断开 1 mol H—Br键所需能量相差约为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带含有丰富的碘。为了从海带中提取碘,某学习小组设计并进行了以下实验:

(1)海带提碘实验中不需要的仪器是_________(选填编号)。
A.![]() B.
B.![]() C.
C.![]() D.
D. ![]()
(2)步骤③的实验操作名称是____________;用到的玻璃仪器有(写仪器名称)_____________________________________。
(3)步骤④反应的离子方程式是__________________________________。
(4)步骤⑤是用有机溶剂将碘从水中提取出来,此过程包含的实验操作是_______________、_______________。不能用酒精代替苯的理由是_________________________(用文字简述)。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法(用文字简述):_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com