
【题目】下列化合物中,其阳离子和阴离子具有相同的电子层数的( )
A. Na2S B. MgCl2 C. KCl D. LiF
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量计算中和热。下列说法正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎泡沫塑料的作用是固定小烧杯
D. 酸或碱的物质的量越大,所测中和热的数值越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨反应中使用的催化剂是______(填名称),该反应温度一般控制在500℃,主要原因是______。
(2)下列措施,既能加快合成氨反应的反应速率,又能增大反应物转化率的是(_____)
A. 使用催化剂 B. 缩小容积体积 C. 提高反应温度 D. 移走NH3
(3)在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件下不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在下图中补充画出从t2到t4时刻正反应速率随时间的变化曲线__________。

(4)常温下,在氨水中加入一定量的氯化铵晶体,下列说法错误的是(________)
A.溶液的pH增大 B.氨水的电离程度减小 C.c(NH4+)减小 D.c(OH-)减小
(5)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色)HZ(蓝色)。通入氨气后石蕊试液呈蓝色,请用平衡移动原理解释____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) ![]() I3-(aq)△H。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
I3-(aq)△H。某I2、KI混合溶液中,I-的物质的量浓度c(I-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是
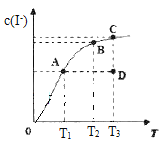
A. 该反应△H<0
B. 若在T1、T2温度下,反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正>v逆
D. 状态A与状态B相比,状态A的c(I3-)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质或用途的描述错误的是( )
A.硝酸是易挥发的强酸
B.水玻璃可用作木材防火剂
C.CO是无色难溶于水的气体
D.Fe3+可以与KSCN溶液反应生成红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室向 0.783g MnO2 中加入 20mL36.5%(ρ=1.18g/cm3 )浓盐酸后,共热制取 Cl2.反应方程式为:MnO2+4HClMnCl2+Cl2+2H2O,若反应后溶液体积仍为 20mL,则下列说法正确的是( )
A.反应消耗 HCl 物质的量为 0.236mol
B.反应生成 Cl2 气体的体积为 201.6mL
C.若取 2mL 反应后的溶液,加入足量 AgNO3,可产生沉淀 2.87g
D.若取 2mL 反应后的溶液,加入 2.0mol/L 的 NaOH,当沉淀达到最大值时,消耗 NaOH 溶液的体积为10.9mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,能实现实验目的的是(必要时可加热)
选项 | 实验目的 | 甲 | 乙 | 丙 |
|
A | 证明浓硫酸具有强氧化性 | 浓硫酸 | 碳粉 | 溴水 | |
B | 验证Cl2无漂白性 | 浓盐酸 | MnO2 | 干燥的红色布条 | |
C | 验证NH3溶于水显碱性 | 浓氨水 | 碱石灰 | 湿润的蓝色石蕊试纸 | |
D | 比较H2CO3和H2SiO3的酸性 | 硼酸溶液 | 碳酸钠 | 硅酸钠溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化学物质,在生产和生活中有多种用途:
(1)从海水中获得食盐的方法称为___________。NaCl的电子式是________。
(2)实验室电解饱和食盐水的装置如下图所示。下列判断正确的是_________(选填编号)。

A.电极a为阴极
B.电极b上发生了还原反应
C.阳极附近溶液变红
D.阴极产生黄绿色气体
(3)工业上用电解饱和食盐水的方法制取氯气。写出该反应的化学方程式:________________________________________________________,若得到氯气1.12L(标准状况下)时,转移的电子数为______mol。
(4)电解时应避免两极产物相互接触,否则可能发生副反应。写出产物中一种单质与一种化合物反应的化学方程式:_______________________________ 。
(5)氯气有毒,但是也可以用来消毒的原因是_________________________。
(6)某同学用氯气做了如下实验:
①向盛有KI溶液的试管中滴加少量氯水后再加入少许CCl4,振荡,静置后可观察到______________________________。
②如果继续向试管中滴加氯水,振荡,CCl4层中颜色会逐渐变浅,最后变成无色。则下列说法正确的是___________
a、CCl4层中溶质被氧化 b、CCl4被氧化
c、CCl4层中溶质被还原 d、CCl4被还原
(7)氢气是一种清洁能源,有人提议通过电解饱和食盐水大规模生产氢气。你是否同意该观点?请用文字作简要解释。______________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com