
����Ŀ����1���ϳɰ���Ӧ��ʹ�õĴ�����______�������ƣ����÷�Ӧ�¶�һ�������500�棬��Ҫԭ����______��
��2�����д�ʩ�����ܼӿ�ϳɰ���Ӧ�ķ�Ӧ���ʣ���������Ӧ��ת���ʵ�����_____��
A. ʹ�ô��� B. ��С�ݻ���� C. ��߷�Ӧ�¶� D. ����NH3
��3����t2ʱ�̣����������ݻ�Ѹ������ԭ����2���������������²��������£�t3ʱ�̴ﵽ�µ�ƽ��״̬��֮���ٸı�������������ͼ�в��仭����t2��t4ʱ������Ӧ������ʱ��ı仯����__________��

��4�������£��ڰ�ˮ�м���һ�������Ȼ�茶��壬����˵�����������________��
A.��Һ��pH���� B.��ˮ�ĵ���̶ȼ�С C.c(NH4+)��С D.c(OH��)��С
��5��ʯ���HZ��ʾ����Һ�д��ڵĵ���ƽ��HZ����ɫ��HZ����ɫ����ͨ�백����ʯ����Һ����ɫ������ƽ���ƶ�ԭ������____________��
���𰸡�����ý ������������ҷ�Ӧ�¶ȽϿ� B  AC ͨ�백��������һˮ�ϰ���һˮ�ϰ�����������������������ӽ�ϣ�ʹ������Ũ�ȼ�С����ʹƽ�������ƶ�������ɫ�������ӣ������Һ����ɫ
AC ͨ�백��������һˮ�ϰ���һˮ�ϰ�����������������������ӽ�ϣ�ʹ������Ũ�ȼ�С����ʹƽ�������ƶ�������ɫ�������ӣ������Һ����ɫ
��������
(1)�ϳɰ���ҵ������ý�������������¶ȿ�����Ӧ���ʣ���߲��������¶�ʱ�������Ļ����������������Ӧ���ʣ���߲������ʴ�Ϊ������ý�������Ļ����¶��ҷ�Ӧ���ʽϿ죻
(2)A.ʹ�ô������ӿ��˷�Ӧ���ʣ����Dz�Ӱ�컯ѧƽ�⣬��Ӧ���ת���ʲ��䣬��A����
B. ��С���������������ѹǿ�������˷�Ӧ���ʣ�ƽ�����������ƶ�����Ӧ��ת��������B��ȷ��
C. ��߷�Ӧ�¶ȣ������˷�Ӧ���ʣ�����ƽ�����������ƶ�����Ӧ��ת���ʼ�С����C����
D. ���߰�������Ӧ���С�����淴Ӧ���ʶ�����С����D����
�ʴ�Ϊ��B��
��3�����������ݻ�Ѹ������ԭ����2�����������������������£��൱�ڼ�Сѹǿ�����淴Ӧ���ʶ���ԭ����С��ƽ�������ƶ�����V����V������ͼ��Ϊ�� ��
��
(4)A.��ˮ�м����Ȼ�泥���Һ�������Ũ������������һˮ�ϰ��ĵ��룬��Һ������������Ũ�ȼ�С����Һ��pH��С����A����
B. ��ˮ�������Ũ������һˮ�ϰ��ĵ���ƽ�����������ƶ�������ˮ�ĵ���ȼ�С����B��ȷ��
C. �������Ȼ�泥���Һ�������Ũ������C����
D. ��ˮ�е������Ũ��������Һ������������Ũ�ȼ�С��c(OH��)��С����D��ȷ��
�ʴ�Ϊ��AC��
��5��ͨ�백������Һ�Լ��ԣ����������ӣ�ʹƽ�����ƣ���Һ����ɫ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڿ�ѧ�о��ͻ����������������Ź㷺��Ӧ�á���ش��������⣺
��1���뵪Ԫ��ͬ��ĵ�������Ԫ�صĻ�̬ԭ�Ӽ۲���ӹ������ʽΪ___________��
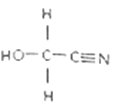
��2��HOCH2CN�Ľṹ��ʽ��ͼ���÷�����������������Ŀ֮��Ϊ___________���������̼ԭ�ӵ��ӻ���ʽΪ___________���������г��������Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ______________________��
��3��[Cu(NH3)4]SO4��һ����Ҫ��������SO42����Ϊ�ȵ�����ķ��ӵĻ�ѧʽΪ___________(��дһ��)��NH3�� VSEPRģ��Ϊ___________��[Cu(NH3)4]2+�Ľṹ����ʾ��ͼ��ʾΪ______________________��
��4������֪��2UO2+5NH4HF2![]() 2UF4��NH4F+3NH3��+4H2O����NH4HF2�в����е�������Ϊ___________(��ѡ����ĸ)��
2UF4��NH4F+3NH3��+4H2O����NH4HF2�в����е�������Ϊ___________(��ѡ����ĸ)��
A.���ۼ� B.��λ�� C.������ D.���Ӽ� E.���
��NH3��H2O�ļ����ɴ�С��˳��Ϊ______________________(�÷���ʽ��ʾ)��ԭ����_______________________________________________________��
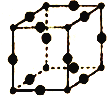
��5��Cu3N�ľ����ṹ��ͼ��ʾ��N3������λ��Ϊ___________��Cu+�뾶Ϊapm��N3���İ뾶Ϊbpm��Cu3N�������ܶ�Ϊ___________g/cm3(�г�����ʽ���ɣ������ӵ�������ֵ��NA��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڷ�Ӧ3Cl2+6KOH![]() KClO3+5KCl+3H2O�У�����˵����ȷ���� ( )
KClO3+5KCl+3H2O�У�����˵����ȷ���� ( )
A.Cl2����������KOH�ǻ�ԭ��
B.KCl���������KClO3�ǻ�ԭ����
C.����ԭ�����뱻����������������Ϊ5:1
D.��Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ6molʱ������3molCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֱȻƽ�Ҫ���ص�18O2���岻�����ҹ����ݽ��������о����Ʊ��ɹ���1mol����18O2���庬�����ӵ����ʵ���Ϊ( )
A. 36 mol B. 20mol C. 16 mol D. 10mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о�����ͬ���Ӳ�����һ��ԭ���ǣ� ��
A. H��He��Li B. Li��Na��K C. Na��Si��Ar D. O��S��Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڴ��л������ܱ������з�����Ӧ�� Fe2O3��3H2==2Fe��3H2O����ȡ���д�ʩ���ܸı䷴Ӧ���ʵ��ǣ� ��
A.����Fe2O3����
B.��������������䣬����H2������
C.����N2������������ѹǿ����
D.����N2�������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û�ԭ�����Խ����᳧�����еĴ�����������(NOx)��ת��Ϊ�����ʡ������£���NO��H2�Ļ������ͨ��Ce(SO4)2��Ce2(SO4)3�Ļ����Һ�У���ת����������ͼ��ʾ������˵������ȷ����
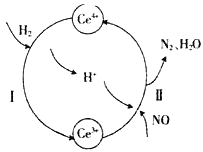
A. ��ӦI�����ӷ�Ӧ����ʽΪ2Ce4++H2=2Ce3++2H+
B. ��ӦII���������뻹ԭ�������ʵ���֮��Ϊ1��2
C. ��Ӧǰ��Һ��c(Ce4+)һ�����ڷ�Ӧ����Һ�е�c(Ce4+)
D. ��Ӧ�����л����Һ��Ce3+��Ce4+���ӵ�����һ�����ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�������,�������Ӻ������Ӿ�����ͬ�ĵ��Ӳ�����( )
A. Na2S B. MgCl2 C. KCl D. LiF
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȽϹ�ҵ�ϳɰ���Ӵ�����������SO2����������������,����˵���д������( )
A.����������������,��ʹ���˺��ʵĴ���
B.��ѡ���˽ϸߵ��¶�
C.��������ʹ����һ��ԭ�Ϲ����������һ��ԭ�������ʵķ���
D.�������˸�ѹ����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com