
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
【答案】B
【解析】
试题A、当AB的浓度改变0.5 molL-1,由方程式A2(g)+B2(g)![]() 2AB(g)知,A2的浓度改变为0.25molL-1,所以a=(0.4-0.25)molL-1=0.15molL-1,即图中a点的值为0.15,故A正确;B、当AB的浓度改变0.5 molL-1,由方程式知,B2的浓度改变为0.25molL-1,所以平衡时B2的浓度为=(0.3-0.25)molL-1=0.05molL-1,K=
2AB(g)知,A2的浓度改变为0.25molL-1,所以a=(0.4-0.25)molL-1=0.15molL-1,即图中a点的值为0.15,故A正确;B、当AB的浓度改变0.5 molL-1,由方程式知,B2的浓度改变为0.25molL-1,所以平衡时B2的浓度为=(0.3-0.25)molL-1=0.05molL-1,K=![]() =
=![]() =
=![]() ,故B错误;C、已知A2(g)+B2(g)2AB(g)释放出热量即△H<0,所以温度升高,平衡逆移,平衡常数K值减小,故C正确;D、当AB的浓度改变0.5 molL-1,由方程式知,A2的浓度改变为0.25molL-1,已知A2的初始量为0.4molL-1,所以平衡时A2的转化率为
,故B错误;C、已知A2(g)+B2(g)2AB(g)释放出热量即△H<0,所以温度升高,平衡逆移,平衡常数K值减小,故C正确;D、当AB的浓度改变0.5 molL-1,由方程式知,A2的浓度改变为0.25molL-1,已知A2的初始量为0.4molL-1,所以平衡时A2的转化率为![]() ×100%=62.5%,故D正确;故选B。
×100%=62.5%,故D正确;故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

图1
(1)写出下列物质的官能团名称:
B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

甲 乙 丙 丁
图2
①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A Na2O2 B KCl C Na2CO3 D MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 2CH2=CH2+O2![]() 是理想的原子经济,原子利用率为100%
是理想的原子经济,原子利用率为100%
B. 石油分馏制得汽油、煤油、柴油等产品
C. 煤干馏的产品很多,属于物理变化
D. 煤的气化主要反应是C(s)+H2O(g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A. 1/2N2(g)+H2O(g ) ===1/2N2H4(g)+1/2O2(g) ΔH=+267 kJ·mol-1
B. N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-133.5 kJ·mol-1
C. N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
D. N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平。
现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

(1)由石油生产A的裂解反应属于_______________(填“化学”或“物理”)变化。
(2)A的结构简式为___________,A在一定条件下可以聚合生成一种常见塑料,该塑料的结构简式为___________。
(3)①的反应类型为__________;D中官能团的名称是__________。
(4)在实验室中获得的乙酸乙酯往往含有B、D,为提纯乙酸乙酯,加入的试剂是_________,分离操作方法是__________。
(5)反应②的化学方程式为__________________________________;反应④的化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列问题。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,其中还原剂是___。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是_____________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____________(填“大于”或“小于”)生成物化学键形成放出的总能量。
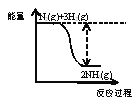
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_____________(填序号)。
a.容器中N2、H2、NH3共存 b.N2、H2、NH3的物质的量之比为1:3:2
c.容器中的压强不随时间变化 d.N2、NH3浓度相等
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为_________。
(4)下列各反应中,符合如图所示能量变化的是_____________(填序号)。

a.H2和Cl2的反应 b.Al和盐酸的反应 c.Na和H2O的反应 d.Ba(OH)2·8H2O和NH4C1的反应
(5)海水资源前景广阔。
①列举一种海水淡化的方法______________。
②采用空气吹出法从海水中提取溴的过程中,吸收剂SO2和溴蒸气反应生成氢溴酸以达到富集的目的,该反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下发明或发现中,属于化学史上中国对世界做出重大贡献的是( )
①造纸 ②印刷技术 ③火药 ④指南针 ⑤烧制陶瓷 ⑥合成有机高分子材料 ⑦人工合成牛胰岛素 ⑧提出原子一分子学说
A.①②③④⑧B.①③⑤⑦C.②④⑤⑦D.⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1 B. 平衡时,Y和Z的生成速率之比为2∶3
C. X、Y的转化率不相等 D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com