
| A. | 金属锂作电池的负极,石墨作电池的正极 | |
| B. | 电解质溶液中不能混入水,必须与空气隔绝 | |
| C. | 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 | |
| D. | 电池工作过程中,金属锂提供的电子与正极区析出的硫物质的量之比为4:1 |
分析 根据电池反应式知,放电时,Li元素化合价由0价变为+1价、S元素化合价由+4价变为0价,所以Li作负极、石墨作正极,负极反应式为Li-e-=Li+,
A.Li失电子作还原剂,被氧化;
B.Li性质较活泼,易和水发生氧化还原反应,和易被氧气氧化;
C.SOCl2生成Li2SO3,硫元素的化合价不变,都是+4价;
D.根据方程式知,放电时,4molLi失去4mol电子,析出1molS.
解答 解:根据电池反应式知,放电时,Li元素化合价由0价变为+1价、S元素化合价由+4价变为0价,所以Li作负极、石墨作正极,负极反应式为Li-e-=Li+,
A.原电池放电时,电子从负极沿导线流向正极,该原电池中,锂易失电子而作负极,石墨作正极,则电子从锂沿导线流向正极石墨,故A正确;
B.Li性质较活泼,易和水发生氧化还原反应,导致SOCl2无法参加反应,所以电解质为非水溶液,易被氧气氧化所以与空气隔绝,故B正确;
C.SOCl2生成Li2SO3,硫元素的化合价不变,都是+4价,所以SOCl2不是被还原生成Li2SO3,故C错误;
D.根据方程式知,放电时,4molLi失去4mol电子,析出1molS,则金属锂提供的电子与正极区析出硫的物质的量之比为4:1,故D正确;
故选C.
点评 本题考查化学电源新型电池,为高考高频点,会根据元素化合价变化确定正负极及发生的反应,难点是电极反应式的书写,知道原电池电解质溶液中阴阳离子移动方向及原因,题目难度不大.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
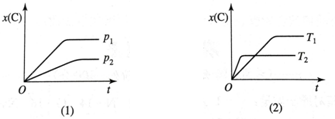
| A. | 吸热反应,m+n<p | B. | 吸热反应,m+n>p | C. | 放热反应,m+n<p | D. | 放热反应,m+n>p |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 项目 | 甲 | 乙 | A |
| 起始时 | 3mol/L | 3mol/L | 0 |
| 2s末 | 1.8mol/L | 2.6mol/L | 0.8mol/L |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 |  | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
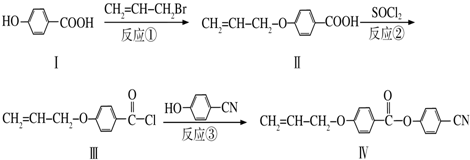
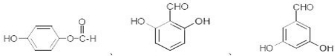 任一种.
任一种.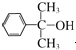 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
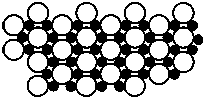 2001年3月发现硼化镁在39K时呈超导性,可 能是人类对超导认识的新里程碑.在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,如图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据下图确定硼化镁的化学式为( )
2001年3月发现硼化镁在39K时呈超导性,可 能是人类对超导认识的新里程碑.在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,如图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上.根据下图确定硼化镁的化学式为( )| A. | MgB | B. | MgB2 | C. | Mg2B | D. | MgB6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1+3Q2>6Q3 | B. | Q1+3Q2<6Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2=Q3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com